Вязкость воды
Вязкость — это физическая характеристика среды, которая определяет ее способность сопротивляться деформации при скольжении слоев жидкости друг относительно друга. Вязкость воды зависит от нескольких факторов, включая ее температуру, давление и наличие добавленных веществ.
При комнатной температуре и атмосферном давлении вода обычно является жидкостью с низкой вязкостью. Это означает, что вода легко течет и имеет мало сопротивления для движущихся частиц. Однако с увеличением температуры вязкость воды уменьшается, что делает ее более текучей и менее плотной.
На вязкость воды также может влиять наличие добавленных веществ, таких как соли или масла. Некоторые добавки могут повышать вязкость воды, делая ее более густой и менее текучей. Например, добавление солей может привести к образованию гидратов, которые изменяют структуру воды и делают ее более плотной.
Вязкость воды также может быть изменена воздействием внешних условий, таких как давление. Повышение давления может увеличить вязкость воды, что приведет к ее более замедленному движению. Это связано с увеличением сил притяжения между молекулами воды под воздействием давления.
Кроме того, вязкость воды может быть измерена с использованием специальных устройств, называемых вискозиметрами. Они позволяют определить силу сопротивления, которую вода оказывает на движение приложенного к ней воздействия.
Изучение вязкости воды важно для многих областей науки и техники. Например, вязкость играет важную роль в гидрологии, где она влияет на движение воды в реках и океанах
Кроме того, знание вязкости воды полезно при проектировании и расчете работы различных механизмов, оборудования и технологических процессов, связанных с применением воды.
Некоторые органические вещества амфифильны[править]
Схема строения молекулы мыла и механизма его моющего действия. Гидрофобные части молекул мыла погружены в загрязняющее вещество (например, жир), гидрофильные — взаимодействуют с водой. В результате загрязнитель превращается в эмульсию и смывается.
Амфифильность — свойство молекул, одна часть которых гидрофильна, а другая гидрофобна. К амфифильным веществам относятся фосфолипиды, жирные кислоты и их соли (например, мыло), а также липопротеиды и др.. Белки также обладают амфифильными свойствами, так как обычно в их состав входят аминокислоты с гидрофильными и с гидрофобными радикалами.
За счет амфифильных свойств фосфолипидов при взаимодействии с водой они формируют мицеллы, липосомы и липидные бислои (см. )..
Амфифильность белков влияет на образуемые ими третичные и четвертичные структуры молекул, а также позволяет молекулам мембранных белков встраиваться в клеточные мембраны.
Гипотеза английского астрофизика Хойла
Британский ученый утверждал, что конденсация первичного водородного облака проходила по-разному во всех зонах Солнечной системы, в первую очередь из-за разницы температур:
- Непосредственно около светила конденсировались металлы, потому что солнечного тепла хватало, чтобы расплавить даже такие тугоплавкие элементы.
- Далее орбиты Сатурна температура была такова, что конденсировались там преимущественно водяные пары. Это объясняет водную природу транссатурновых объектов.
Но процесс происхождения дальних планетарных тел не был гладким. По какой-то причине вырванные из них глыбы льда полетели в направлении ближних планет. Часть объектов таяла по дороге, но крупные экземпляры не успевали растаять под воздействием лучей Солнца, долетали до Земли, оседали в ее атмосфере ледяными каплями, превращаясь в дожди.
Математическими расчетами Хойл доказал, что таких осадков было достаточно, чтобы за несколько миллионов лет образовать океаны.
В процессе формирования внешних планет имело место гравитационное «выталкивание» глыб льда в область внутренних планет. Огромные глыбы, не успев полностью испариться от солнечных лучей, достигали Земли и падали на нее в виде с ледяного «дождя». Credit: photo.nationalgeographic.fr/историиземли.рф.
Роль водорода и кислорода в процессе формирования воды
Вода – это одно из самых важных веществ на планете Земля. Она является основой жизни и обладает уникальными свойствами. Но каким образом вода появилась на Земле? В этом процессе ключевую роль играют два элемента – водород и кислород.
Водород – самый легкий элемент в периодической таблице, поэтому он достаточно распространен во Вселенной. Водородные атомы состоят из протона и электрона, их ядра не содержат нейтронов. Водород образует отдельные молекулы и может вступать в химические реакции с другими элементами.
Кислород – второй по распространенности элемент во Вселенной. Он составляет примерно 20% атмосферы Земли. Кислородные атомы состоят из восьми протонов, восьми нейтронов и восьми электронов. Кислород – очень реактивный элемент и способен вступать в соединения с различными веществами.
В процессе формирования воды, атомы водорода и кислорода соединяются, образуя молекулу воды – H2O. Вода является полярным соединением, так как атомы кислорода сильнее притягивают электроны, образуя отрицательную часть молекулы, а атомы водорода – положительную часть.
Водородные связи между молекулами воды придают ей уникальные физические и химические свойства. Благодаря этим связям вода обладает высокой теплоемкостью, что способствует поддержанию стабильной температуры на планете. Они также обусловливают свойство воды расширяться при замерзании, что является редкостью среди жидкостей и оказывает влияние на климатические процессы.
История формирования воды на Земле связана с множеством различных процессов. Она могла образоваться как в результате химических реакций в атмосфере и на поверхности планеты, так и постепенно поступать на Землю с более отдаленных пространственных объектов, таких как кометы.
Аномальные свойства воды
Изучению внутреннего строения воды посвящены исследования фундаментального характера. По степени изученности некоторых свойств вода значительно превосходит другие вещества. Однако многие существенные особенности строения и свойства воды остаются еще невыясненными. Выявляются все новые свойства воды. Они не были известны раньше и не находят пока объяснения на основе прежних представлений о внутреннем ее строении.
Нас интересуют те особенности строения молекулы воды, которые придают ей интенсивную растворяющую способность и с которыми связаны специфические свойства, известные под названием аномалий воды. Еще в двадцатых годах нашего века на основе учения о полярной структуре молекул воды были разработаны простейшие представления об ассоциации молекул в жидкой воде как результат взаимодействия диполей. Эти представления заключаются в следующем.
Одной из особенностей строения молекулы воды является несимметричное расположение атомов водорода вокруг атома кислорода: они расположены не по прямой, проведенной через центр атома кислорода, а под углом (рис. 1). Центры ядер атомов водорода расположены на расстоянии 9,5*10-8 см от центра атома кислорода. Угол между линиями, соединяющими центры атомов кислорода и водорода, равен 104,5°. Связь между атомами кислорода и водорода в молекуле воды осуществляется электронами. Вследствие несимметричности распределения электрических зарядов молекула воды обладает полярностью, т. е. имеет два полюса — положительный и отрицательный, которые так же, как и магнит, создают вокруг нее силовые поля.
Таким образом, для молекулы воды характерно дипольное строение (диполи). Их изображают в виде овалов, полюса которых имеют противоположные по знаку электрические заряды. При достаточном сближении молекулы воды начинают действовать друг на друга своими силовыми полями. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный другой. В результате могут получиться агрегаты из двух, трех и более молекул (рис. 2).
Рис. 1. Положение ядер водорода относительно атома кислорода в молекуле воды.
Рис. 2. Образование диполями воды ассоциированных молекул (дигидроля).
Такие группировки молекул воды называются дигидролями и тригидролями. Следовательно, в воде одновременно присутствуют одиночные (моногидроли), двойные и тройные молекулы. Содержание их меняется в зависимости от температуры. Во льду доминируют тройные молекулы, обладающие наибольшим объемом. При повышении температуры скорость движения молекул возрастает, и силы притяжения между молекулами оказываются недостаточными для удержания их друг около друга. В жидком состоянии вода представляет смесь дигидролей, тригидролей и моногидролей. С увеличением температуры тройные и двойные молекулы распадаются, при 100 °С вода состоит главным образом из моногидролей.
Хотя изложенные представления о строении воды были пересмотрены (рис. 3), основные выводы об известном соответствии структур, возникающих из связанных между собой молекул в жидкой воде и во льду, получили подтверждение и при последующих исследованиях. В дальнейшем разными исследователями на основе результатов, полученных с помощью экспериментальных методов, были разработаны различные теории жидкого состояния воды, но ни одна из них не находится еще в достаточном согласии со всей совокупностью экспериментальных данных о свойствах воды. Можно считать, что в жидкой воде находятся в динамическом равновесии образования из тетраэдрически связанных молекул и частично или полностью свободных молекул. Химически чистая вода обладает рядом аномальных свойств:
1) при нагревании воды от 0 до 4°С ее объем не увеличивается, а уменьшается, и максимальная плотность ее достигается не в точке замерзания (0°С), а при 4°С (точнее 3,98 °С);
2) вода при замерзании расширяется, а не сжимается, как все другие тела, плотность ее уменьшается;
3) температура замерзания воды с увеличением давления понижается, а не повышается, как этого следовало бы ожидать;
4) удельная теплоемкость воды чрезвычайно велика по сравнению с теплоемкостью других тел;
5) вследствие высокой диэлектрической постоянной вода обладает большей растворяющей и диссоциирующей способностью, чем другие жидкости;
6) вода обладает самым большим поверхностным натяжением из всех жидкостей, за исключением ртути;
Поверхностное натяжение и плотность определяют высоту, на которую может подняться жидкость в капиллярной системе при фильтрации через пористые среды.
Причина перечисленных аномальных свойств воды заключается в особенностях строения ее молекул.
Температура
Благодаря комбинациям атомов у разных веществ молекулы неодинаковы. А если рассмотреть одно вещество, но в разных ситуациях, например, воду из водопроводного крана, в кружке чая или весеннем ручейке. Во всех трех случаях молекулы одни и те же, но ведут они себя по-разному. В горячем чае молекулы движутся наиболее быстро. В холодном ручейке гораздо медленнее. А в воде из крана молекулы движутся медленнее, чем в горячем чае, но быстрее, чем в ручейке.

Конечно, речь здесь идет о таких скоростях, с которыми человек не может передвигаться. Человек может идти со скоростью 4 – 7 км/ч. Скорость молекулы воды при комнатной температуре в среднем 590 м/с = 2124 км/ч (в кипящей воде — ≈ 2340км/ч) Это надо понимать, когда говорят, что одни молекулы движутся быстро, а другие медленно.
Когда говорят «холодно», «тепло», «горячо», то сравнивают температуру. Определяется температура любого тела тем, как движутся молекулы этого тела: быстро или медленно. Температура тем выше, чем быстрее передвигаются молекулы. Если же молекулы начинают двигаться медленнее, то и температура тела понижается.
Окружающая нас природа зависит от температуры. С понижением ее приходит осень, а потом зима. С ростом температуры зима уступает место весне, а весна – лету.
Свойства вещества также зависят от температуры. Например, мягкая резина на холоде становится твердой, а твердый лед превращается в жидкость, если его занести в теплую комнату.
Температура характеризует свойства живой и неживой природы. Значит, о ней многое нужно знать. Главное надо запомнить это: скорость движения молекул, образующих вещество, определяет его температуру.
Чтобы измерить температуру, используют приборы – термометры. Термометры бывают по назначению:
- лабораторные;
- медицинские;
- уличные;
- комнатные;
- технические.
по конструкции:
- жидкостные;
- газовые;
- механические;
- электрические;
- оптические.
Температура измеряется в градусах. В 1742 году шведский геолог, метеоролог и астроном Андрес Цельсий придумал шкалу, в основе которой лежат отсчетные точки: температура таяния льда (0 градусов) и температура кипения воды (100 градусов).
 (Источник)
(Источник)
В 1848 году Уильям Томсон (лорд Кельвин) ввел понятие абсолютного нуля температуры (-273 градуса, минимальная возможная температура во Вселенной). При этом, температура таяния льда уже 273 градуса и соответственно кипения воды 373 градуса.
 (Источник)
(Источник)
В 1724 году польско-немецкий ученый Даниель Габриель Фаренгейт создал свою шкалу, которая использовала в англоязычных странах. Сейчас она используется только в США.
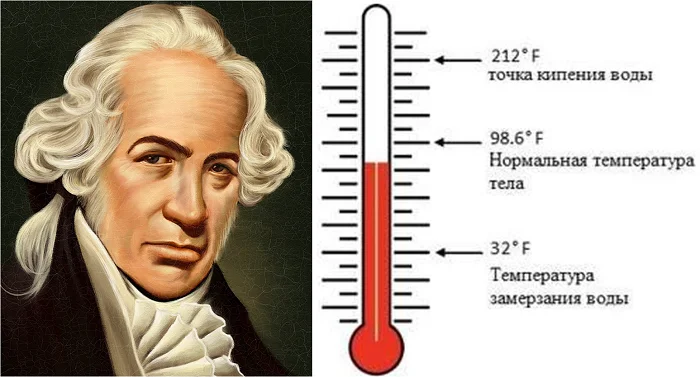 (Источник)
(Источник)
На всех трех шкалах используются две основные точки – температуры перехода выбранного вещества из одного состояния в другое.
На шкалах Цельсия и Кельвина этим веществом выбраны вода, а две точки – это температура таяния льда и кипения воды. Промежуток между этими температурами разделен на 100 частей, таким образом получен 1 градус.
Цельсий выбрал за 0о температуру плавления льда. Кельвин обозначил нулем минимальную возможную температуру (когда движение молекул прекращено). Тогда по Цельсию лед плавится при 0о С (по Кельвину при — 273о К), вода кипит при 100о С, а по Кельвину при 373о К, так как нуль Кельвина ниже нуля Цельсия на 273о. При переходе от градусов Цельсия к градусам Кельвина нужно прибавлять 273 градуса.
Фаренгейт основными точками назвал температуру, близкую к температуре застывания ртути и нормальную температуру человеческого тела. В результате температура таяния льда Фаренгейта выше примерно на 32 градуса температуры Цельсия.
Пример перехода от одной шкалы к другой:
нормальная комнатная температура
- по шкале Цельсия – 20о С;
- по шкале Кельвина – оС + 273о = 20о С + 273о = 293о К;
- по шкале Фаренгейта – о С ∙ 9/5 + 32о = 20о С ∙ 9/5 + 32о = 68о F.
Наиболее рациональной и простой в использовании считается шкала Цельсия.
(Подробно температура изучается в старших классах в разделах «Тепловые явления» и «Термодинамика»).
Молекулы в любых условиях движутся постоянно и хаотично. Движение влияет на температуру, поэтому называется оно тепловым. Тепловое движение передается и броуновским частицам. Определение этого явления: движение частиц твердого вещества, попавших в жидкость, под действием теплового движения молекул жидкости называется броуновским движением.
Итак:
- Движение молекул определяет температуру тела
- Температура измеряется термометром по шкалам Цельсия, Кельвина, Фаренгейта
- Температура – физическая характеристика тела
Гипотеза «горячего» происхождения планеты
Большинство ученых, выдвигающих гипотезу «горячего» происхождения Земли, никак не связывают появление воды на планете с . Ученые предположили, что в структуре планеты Земля изначально присутствовали водородные пласты, которые в дальнейшем вступили в химическую реакцию с кислородом, находившимся в земельной мантии на начальном этапе формирования. Результатом данного взаимодействия явилось появление огромного количества воды на планете.
Тем не менее, часть ученых не исключают участие астероидов и комет в создании водного пространства на огромной территории земли. Они предполагают, что именно благодаря непрерывным атакам со стороны больших комет и астероидов, которые несли в себе резервы воды в виде жидкости, льда и пара, появились огромные водные пространства, заполняющие большую часть планеты Земля.
Во все времена люди хотели знать, каким образом образовалась планета Земля. Несмотря на то, что существует масса гипотез, вопрос о происхождении воды на нашей планете по-прежнему остается открытым.
Жизнь всего живого на Земле зависит от так необходимой прозрачной жидкости, но при этом никто достоверно не знает, откуда берется вода и как она появилась на нашей планете. Некоторую надежду внушают последние находки, подтверждающие наличие воды в том или ином виде на многих других небесных телах. Это дает небольшую надежду на то, что во Вселенной мы не одиноки.
В чем разница пара и воды, что объединяет эти два состояния
Молекула воды как таковая, это и есть молекула пара, исходя из их состава. То есть общее между ними то, что кислород и водород в одинаковых количествах находятся в обеих молекулах. Можно отметить, что они отталкиваются друг от друга постоянно и быстро, это свойство тоже объединяет их между собой.
Основные отличия молекулы пара от молекулы воды:
- Пар состоит из молекул, где атомы находятся на расстоянии большем, чем сама молекула, а в воде же все наоборот — очень близко.
- Газы не имеют формы, и могут, как сжиматься, так и расширяться в разные стороны, благодаря силе, с которой атомы и молекулы отталкиваются.
- Вода обладает текучестью, в отличие от пара, она принимает форму сосуда, в котором находится, ведь молекулы друг от друга слишком близко.
- Газ может создавать давление, когда молекулы отталкиваются друг от друга, они могут вытолкнуть пробку из шампанского, например.
- А вода не может оказывать давление на предметы, так как молекулы внутри воды двигаются беспорядочно, а не сталкиваясь непосредственно друг с другом.
- Вода – это химический элемент (вещество), а пар – физическое состояние воды.
Откуда берется вода в водопроводе?
Но чаще всего нас волнуют более насущные проблемы, чем природа происхождения воды. Гораздо интересней, как она попадает в наши краны
и дальше «перекочевывает» в чайники и кастрюли.
Согласно разработанным гигиеническим стандартам существует:
- Резервуар, из которого под нужды населения забирается вода.
- Целый ряд водозаборных сооружений, которые осуществляют забор и фильтрацию жидкости.
- Разветвленная система водоснабжения. Те самые трубы, по которым жидкость течет в наши дома.
За качеством воды регулярно следят, соблюдая ГОСТ и прочие нормы. Вот только качество водопроводных труб оставляет желать лучшего
.
Даже если «на входе» в систему вода была идеально чистой, «на выходе» она не всегда пригодная для употребления. Поэтому воду с крана лучше отфильтровать и прокипятить
.
Некоторые увлекаются отстаиванием, замораживанием и прочими сложными системами фильтрации
Если бы мы находились где-то в Нигерии, такие меры предосторожности имели бы право на существование. Но на постсоветском пространстве с водой из трубопровода все не так плохо

По их отношению к воде все вещества делятся на гидрофильные и гидрофобные[править]
Капелька росы на гидрофобной поверхности листа
Все вещества по отношению их к воде в первом приближении делятся на гидрофильные и гидрофобные. Гидрофильные («любящие воду») вещества обычно имеют полярные молекулы (или кристаллические решетки с ионными связями).
Многие гидрофильные вещества хорошо растворяются в воде (а если это жидкости — то смешиваются с ней в любых соотношениях). К гидрофильным веществам можно отнести поваренную соль NaCl, аммиак NH3, спирт C2H5OH.
Но многие гидрофильные вещества нерастворимы. Тогда их поверхность хорошо смачивается водой. К таким веществам относится, например, шерсть (состоящая из белка кератина), бумага (состоящая из целлюлозы) и др.
Гидрофобные («боящиеся воды») вещества плохо растворяются в воде, не смачиваются ею (а если это жидкости — то не смешиваются с ней).
- Вопрос 1
- Почему вещества с полярными молекулами и ионной кристаллической решеткой гидрофильны, а вещества с неполярными молекулами гидрофобны?
- Вопрос 2
- Почему некоторые гидрофильные вещества растворимы в воде, а другие — нет?
Гидрофильность и гидрофобность — частный случай лиофильности и лиофобности. Кроме гидрофильности, можно говорить про липофильность (олеофильность) и др.
Задача 1
Мениск — поверхность воды, налитой, например. в пробирку. Какую форму — вогнутую или выпуклую — будет иметь мениск, если налить воду в пробирку из гидрофильного материала? гидрофобного материала? Объясните, почему.
Задача 1 к разделу «Вода» (ответ)
Мениск — искривлённая свободная поверхность жидкости в месте её соприкосновения с поверхностью твёрдого тела. В пробирке из гидрофильного материала мениск будет вогнутым, а из гидрофобного — выпуклым. В первом случае взаимное притяжение молекул жидкости (когезия) слабее их притяжения молекулами поверхности твёрдого тела (адгезии). Во втором, наоборот, силы когезии преобладают над силами адгезии. A: Вогнутый мениск.B: Выпуклый мениск.
Появление Земли
Земля — одна из планет Солнечной системы, возникла около 4,54 миллиардов лет назад. Ее происхождение связано с процессами, происходившими во Вселенной и на ранних стадиях формирования нашего Солнечной системы.
По мнению ученых, Земля образовалась из газо-пылевого облака, оставшегося после взрыва сверхновой звезды. Это облако начало сжиматься под воздействием силы гравитации. В результате сжатия облака возник диск, вращающийся вокруг центральной точки.
Постепенно, в определенных областях внутри диска начали скапливаться частички пыли и газа, образуя так называемые протопланеты. Одной из таких протопланетой и стала Земля.
В начале своего существования Земля находилась в жидком состоянии и испускала большое количество паров воды и других газов в атмосферу. В процессе охлаждения поверхности планеты вода начала конденсироваться и образовывать океаны.
Позднее на поверхности Земли появилась первичная кора из гранита и базальта, образовавшаяся в результате вулканической активности. Это стало началом формирования суши. Первые континенты плавали на поверхности океана и назывались «археи». Они были гораздо меньше и в другом расположении, чем современные континенты.
С течением времени, континенты переформировывались: сливались вместе, раскалывались или смещались. Такой процесс называется плиточкой тектоникой. Он продолжается и по сей день.
Таким образом, появление Земли было результатом множества сложных физических и химических процессов, происходивших во Вселенной и в Солнечной системе. Вода и Земля возникли сразу и являются важнейшими компонентами нашей планеты.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.

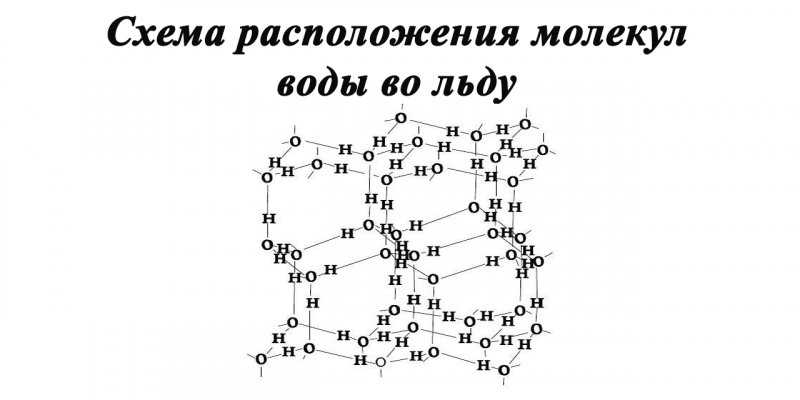
Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.


























