Содержание
В субатомные частицы Они меньше атома и встречаются в природе, почти все они составляют ее часть. Мы хорошо знаем основные и наиболее стабильные из них: электрон, протон и нейтрон.
Вся материя состоит из этих частиц, хотя есть и другие, хотя их существование долгое время игнорировалось. Первые модели атомов, датируемые несколькими столетиями до нашей эры, предполагали, что атомы неделимы, что-то вроде мрамора, который при определенном соединении дает начало различным элементам.
Когда стало известно, что это не так, благодаря открытиям электрона в 19 веке и атомного ядра в начале 20 века, ученые задались вопросом, имеют ли эти частицы внутреннюю структуру.
Оказалось, что да, и протон, и нейтрон — это частицы, состоящие из еще более мелких, у которых нет внутренней структуры: это элементарные частицы.
Вот почему субатомные частицы делятся на:
- Композитные частицы.
- Элементарные частицы.
Элементарные частицы — кварки, глюоны и лептоны. Кварки и глюоны составляют протоны и нейтроны, а электрон, элементарная частица, представляет собой лептон.
Características principales

Протоны и нейтроны можно разделить на более простые частицы, называемые кварками. Субатомные частицы классифицируются по различным стандартам. Например, самые известные и стабильные частицы бывают трех типов: электроны, протоны и нейтроны. Частицы, которые отличаются друг от друга своим зарядом (отрицательный, положительный и нейтральный соответственно) и массой, или потому, что электроны являются основными элементами, а последние два — составными. Кроме того, электроны вращаются вокруг ядра, а протоны и нейтроны составляют ядро.
С другой стороны, протоны и нейтроны, как составные частицы, можно разделить на другие частицы, называемые кварками, которые связаны между собой другими типами частиц, называемыми глюонами. И кварки, и глюоны — неделимые частицы, то есть элементарные частицы. Есть шесть типов кварков: вверх (вверх), вниз (вниз), очарование (очарование), странное (странность), верх (высшее) и низ (низшее).
Точно так же есть фотоны, которые являются субатомными частицами, ответственными за электромагнитное взаимодействие, и нейтрино и калибровочные бозоны, которые отвечают за слабые ядерные силы. Наконец, есть бозон Хиггса, частица, открытая в 2012 году, которая отвечает за массу всех других элементарных частиц (всего, что составляет Вселенную).
Поведение элементарных частиц — вызов для науки. Хотя квантовая механика и стандартная модель элементарных частиц на удивление успешно описывают теоретические основы этого субатомного мира, все еще существует теория, которая может объяснить все поведение Вселенной, который может связать квантовую механику с теорией относительности Эйнштейна. Сегодня существует несколько таких теорий, например теория струн, но их достоверность еще не подтверждена экспериментально.
Композитные субатомные частицы
Составные частицы — первые обнаруженные субатомные образования. Долгое время (до середины ХХ века существование других людей предполагалось) люди считали себя единственным существованием. Однако эти субатомные частицы образованы объединением элементарных частиц, что мы увидим в следующем пункте.
протон
Атом состоит из атомного ядра, состоящего из протонов и нейтронов, и орбиты электронов вокруг него. Протон — это субатомная частица с гораздо большим положительным зарядом, чем электрон. По факту, его качество в 2000 раз выше, чем у него.
Следует отметить, что количество протонов определяет химический элемент. Следовательно, у атомов водорода всегда есть протоны.
Нейтрон
Нейтроны — это субатомные частицы, составляющие ядро вместе с протонами. Его масса очень похожа на массу протона, хотя в данном случае у него нет заряда. Число нейтронов в ядре не определяет элемент (как и протоны), но оно определяет изотоп, который является более или менее стабильным вариантом элемента, который теряет или приобретает нейтроны.
Адрон
Адроны — это субатомные частицы, состоящие из кварков, и мы увидим эти элементарные частицы позже. Чтобы не попасть в слишком сложные области, давайте сохраним идею о том, что эти частицы удерживают кварки вместе из-за очень сильные ядерные взаимодействия.
электрон
Сам электрон уже является субатомной частицей, потому что он может существовать независимо от атомов и не образуется в результате объединения других частиц. Это частица в 2.000 раз меньше протона и имеет отрицательный заряд. Фактически, это самая маленькая заряженная единица в природе.
Кварк
Кварки входят в состав протонов и нейтронов. Сегодня известно шесть из этих субатомных частиц, но, похоже, ни одна из них не существует независимо от атома. Другими словами, кварки всегда образуют протоны и нейтроны.
Итак, эти две субатомные частицы существуют в зависимости от типа кварка, из которого они состоят. Другими словами, если образуется химический элемент или другой химический элемент это зависит от организации шести кварков. Его существование было подтверждено в 1960-х годах.
Бозон
Бозон — это субатомная частица, которая объясняет природу всех основных взаимодействий во Вселенной, кроме гравитации. Это частицы, которые каким-то образом передают силу взаимодействия между остальными частицами. Это частицы, которые несут в себе силу, удерживающую протоны и нейтроны вместе, электромагнитную силу. (который связывает электроны с ядром, чтобы заставить его вращаться) и излучение.
Я надеюсь, что с этой информацией вы сможете больше узнать о субатомных частицах и их характеристиках.
Все об атомах
Мы называем атомами частицы, из которых построены молекулы. Дальше будет видно, имеет ли право атом до сих пор носить свое имя – «неделимый».
Не все атомы одинаковы: сейчас известно немногим более ста видов, или сортов атомов. Вместо того, чтобы говорить «сорт атомов» или «вид атомов», химики говорят «химический элемент» или просто «элемент». Следовательно, известно немногим более ста химических элементов.
Каждый химический элемент имеет свое собственное название, например азот, кислород, ртуть, сера, бром, водород, углерод, натрий, уран, железо, кальций, хлор и т. д. Вы можете оказать, что это вовсе никакие не элементы и не «виды атомов», а попросту названия веществ, многие из которых хорошо вам знакомы. Азот и кислород – газы, входящие, в состав атмосферного воздуха, ртуть – блестящий жидкий металл, сера – желтое горючее вещество и т. д.
Ваше сомнение законно, но мы разъясним его несколько позже. Элементы и служат тем строительным материалом, из которого построены псе известные нам молекулы, все химические вещества.
Элементы отличаются друг от друга весом атомов, их способностью соединяться между собой и многими другими признаками, но самое главное, самое основное различие заключается в устройстве, в строении атомов. Атомы водорода устроены не так, как атомы углерода, атомы углерода не так, как атомы серы. Каждый элемент имеет свое собственное, особое строение атомов.
Проще всего устроен атом водорода. Он состоит всего из двух частиц: атомного ядра и вращающегося вокруг него электрона. Эти частицы не очень сильно отличаются по размерам, диаметр ядра примерно в 10 раз больше диаметра электрона, но различие в их массах огромно: атомное ядро почти в 2 000 раз тяжелее электрона. Практически вся масса атома сосредоточена в его ядре. И атомное ядро и электрон несут на себе электрические заряды: ядро – один положительный, а электрон – один отрицательный заряд. Так как электрические заряды ядра и электрона равны и противоположны, то они уравновешивают друг друга, и атом в целом оказывается электронейтральным (как бы не имеющим электрического заряда).
У каждого элемента своя масса ядра, свой положительный заряд ядра и соответствующее ему число электронов. Этим элементы отличаются друг от друга. Почти у всех элементов электроны расположены на нескольких орбитах, на разных расстояниях от атомного ядра. Распределение электронов по орбитам характерно для каждого элемента.
Например, внешнюю, самую далекую от ядра орбиту атома хлора нам нужно было бы сделать диаметром около 150 метров, а самую близкую – диаметром 6 метров.
Итак, атомы далеко не первичные и не простейшие частицы вещества. Даже по нашему весьма поверхностному описанию вы можете судить, насколько они сложны. Вы знаете, что современная наука нашла способы расщеплять и создавать атомы и что на этом основано использование атомной энергии. И тем не менее даже сегодня для химиков атомы по-прежнему «неделимы». Дело в том, что атомы очень прочные частицы, они неизмеримо прочнее молекул. Молекулы сахара, например, начинают разрушаться уже при 150° При 1500° вполне ощутимо идет разрушение молекул воды, температура в 6000° вполне достаточна, чтобы разрушить почти все известные нам молекулы. Другое дело атомы: чтобы разрушить атомы, нужны температуры, измеряемые миллионами градусов, или совсем особые средства, вроде бомбардировки атомов другими частицами. Поэтому при химических реакциях, даже самых энергичных и бурных, атомы не разрушаются. Неразрушимость атомов при химических реакциях – основной закон химии. Химики твердо знают, что при химической реакции ни один атом не исчезнет и не возникнет. Власть химиков над атомами ограничена: они любыми доступными способами переставляют атомы из молекулы в молекулу, но сами атомы остаются при этом неделимыми.
Эксперимент Юнга
В ходе эксперимента на экран с двумя прорезанными в нем щелями был направлен поток электронов. Проходя через эти прорези, электроны сталкивались с поверхностью еще одного – проекционного – экрана, оставляя на нем свой след. В результате такой «бомбардировки» на проекционном экране появлялась интерференционная картина, подобная той, которая появилась бы, если бы через две прорези проходили бы волны, но не частицы.
Такой рисунок возникает из-за того, что волна, проходя между двух щелей, делится на две волны. В результате дальнейшего движения волны накладываются друг на друга, и на некоторых участках происходит их взаимное гашение. В результате мы получаем много полос на проекционном экране, вместо одной, как это было бы, если бы электрон вел себя как частица.
Интерференционная картина
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Структура и принципы строения атома
Как известно, все материальное во Вселенной состоит из атомов. Атом – это мельчайшая единица материи, которая несет в себе ее свойства. В свою очередь, структура атома складывается из волшебного триединства микрочастиц: протонов, нейтронов и электронов.
При этом каждая из микрочастиц универсальна. То есть, не найти на свете двух разных протонов, нейтронов или электронов. Все они абсолютно друг на друга похожи. И свойства атома будут зависеть только от количественного состава этих микрочастиц в общем строении атома.
Например, структура атома водорода состоит из одного протона и одного электрона. Следующий по сложности, атом гелия состоит из двух протонов, двух нейтронов и двух электронов. Атом лития — из трех протонов, четырех нейтронов и трех электронов и т. д.
Атомы соединяются в молекулы, а молекулы — в вещества, минералы и организмы. Молекула ДНК, являющаяся основой всего живого – структура, собранная из тех же трех волшебных кирпичиков мироздания, что и камень, лежащий на дороге. Хотя эта структура и намного более сложная.
Еще более удивительные факты открываются тогда, когда мы пытаемся поближе рассмотреть пропорции и строение атомной системы. Известно, что атом состоит из ядра и электронов, двигающихся вокруг него по траектории, описывающей сферу. То есть это даже нельзя назвать движением в обычном понимании этого слова. Электрон скорее находится везде и сразу в пределах этой сферы, создавая вокруг ядра электронное облако и формируя электромагнитное поле.
Ядро атома состоит из протонов и нейтронов, и в нем сосредоточена почти вся масса системы. Но при этом, само ядро настолько мало, что если увеличить его радиус до масштаба в 1 см, то радиус всей структуры атома достигнет сотни метров. Таким образом, все, что мы воспринимаем как плотную материю, более чем на 99% состоит из одних только энергетических связей между физическими частицами и менее чем 1% — из самих физических форм.
Но что представляют собой эти физические формы? Из чего они состоят, и насколько они материальны? Чтобы ответить на эти вопросы, давайте подробнее рассмотрим структуры протонов, нейтронов и электронов. Итак, мы спускаемся еще на одну ступеньку в глубины микромира – на уровень субатомных частиц.
Общая характеристика строения атома[править]
Современные представления о строении атома базируются на квантовой механике. На популярном уровне строение атома можно изложить в рамках волновой модели, которая опирается на модель Бора и дополнительные заявления квантовой механики.
- Атомы состоят из элементарных частиц (протонов, электронов, и нейтронов). Масса атома в основном сосредоточена в ядре, поэтому большая часть объема относительно пуста. Ядро окружено электронами. Количество электронов равно количеству протонов в ядре, количество протонов определяет порядковый номер элемента в периодической системе. В нейтральном атоме суммарный отрицательный заряд электронов равен положительному заряду протонов. Атомы одного элемента с разным количеством нейтронов называются изотопами.
- В центре атома находится крошечное, положительно заряженное ядро, состоящее из протонов и нейтронов.
Ядро атома примерно в 100 000 раз меньше, чем сам атом. Таким образом, если увеличить атом до размеров аэропорта Борисполь, размер ядра будет меньше размера шарика для настольного тенниса.
- Ядро окружено электронным облаком, которое занимает большую часть его объема. В электронном облаке можно выделить оболочки, для каждой из которых существует несколько возможных орбиталей. Заполненные орбитали составляют электронную конфигурацию, характерную для каждого химического элемента.
- Каждая орбиталь может содержать до двух электронов, характеризующихся тремя квантовыми числами: основным, орбитальным и магнитным.
- Каждый электрон на орбитали имеет уникальное значение четвертого квантового числа: спина.
Орбитали определяются специфическим распределением вероятности того, где именно можно найти электрон. Примеры орбиталей и их обозначения приведены на рисунке справа. «Границей» орбитали считается расстояние, на котором вероятность того, что электрон может находиться вне ее, меньше 90 %.
- Каждая оболочка может содержать не больше строго определенного числа электронов. Например, ближайшая к ядру оболочка может иметь максимум два электрона, следующая — 8, третья от ядра — 18.
- Когда электроны присоединяются к атому, они занимают орбиталь с низкой энергией. Только электроны внешней оболочки могут участвовать в образовании межатомных связей. Атомы могут отдавать и присоединять электроны, становясь положительно или отрицательно заряженными ионами.
- Химические свойства элемента определяются тем, с какой легкостью ядро может отдавать или получать электроны. Это зависит как от числа электронов, так и от степени заполненности внешней оболочки.
Электронные оболочки и орбиталиправить
Сложные атомы имеют десятки, а для очень тяжелых элементов, даже сотни электронов. Электронные состояния атомов формируются всеми электронами, и невозможно определить, где находится каждый из них. Однако, в так называемом одноэлектронном приближении, можно говорить об определенных энергетических состояниях отдельных электронов.
Согласно этим представлениям существует определенный набор орбиталей, которые заполняются электронами атома. Эти орбитали образуют определенную электронную конфигурацию. На каждой орбитали может находиться не более чем два электрона (принцип исключения Паули). Орбитали группируются в оболочки, каждая из которых может иметь лишь определенное фиксированное количество орбиталей (1, 4, 10 и т. д.). Орбитали разделяют на внутренние и внешние. В основном состоянии атома внутренние оболочки полностью заполнены электронами.
На внутренних орбиталях электроны сильно связаны с ядром. Чтобы вырвать электрон из внутренней орбитали, нужно предоставить ему большую энергию, до нескольких тысяч электрон-вольт. Такую энергию электрон на внутренней оболочке может получить только поглотив квант рентгеновского излучения. Энергии внутренних оболочек атомов индивидуальные для каждого химического элемента, а потому по спектру рентгеновского поглощения можно идентифицировать атом. Эту индивидуальность используют в некоторых методах рентгеновской спектроскопии, в частности в рентгенофлуоресцентном анализе, рентгеновской спектроскопии поглощения, рентгеновской фотоэлектронной спектроскопии.
На внешней оболочке электроны находятся на большем расстоянии от ядра и слабее связаны с ним. Именно эти электроны участвуют в формировании химических связей, поэтому внешнюю оболочку называют валентной, а электроны внешней оболочки — валентными электронами.
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами — 126) элементов, не считая изотопов. Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Вселенная
Трубка Крукса
Сэр Уильям Крукс (1832-1919) разработал трубку, носящую его имя, примерно в 1870 году с намерением тщательно изучить природу катодных лучей. Он добавил электрические и магнитные поля и заметил, что лучи отклоняются ими.
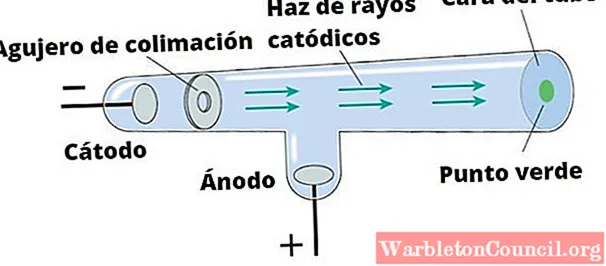
Таким образом, Крукс и другие исследователи, включая Томсона, обнаружили, что:
- Электрический ток генерировался внутри электронно-лучевой трубки.
- Лучи отклонялись магнитным полем так же, как и отрицательно заряженные частицы.
- Любой металл, использованный для изготовления катода, одинаково хорошо генерировал катодные лучи, и их поведение не зависело от материала.
Эти наблюдения вызвали дискуссию о происхождении катодных лучей. Те, кто утверждал, что это были волны, основывались на том факте, что катодные лучи могут двигаться по прямой линии. Кроме того, эта гипотеза очень хорошо объясняла тень, которую помещенный твердый объект отбрасывал на стенку трубки, и при определенных обстоятельствах было известно, что волны могут вызывать флуоресценцию.
Но с другой стороны, было непонятно, как магнитные поля могут отклонять катодные лучи. Это можно было бы объяснить, только если бы эти лучи считались частицами — гипотеза, которую разделял Томсон.
Недостатки и ограничения модели
В то время атомная модель Томсона смогла очень хорошо объяснить химическое поведение веществ. Он также правильно объяснил явления, происходящие в электронно-лучевой трубке.
Но на самом деле Томсон даже не называл свои частицы «электронами», хотя этот термин уже был введен ранее Джорджем Джонстоном Стоуни. Томсон просто назвал их «корпускулами».
Хотя Томсон использовал все знания, доступные ему в то время, в его модели есть несколько важных ограничений, которые стали очевидны очень рано:
–Положительный заряд не распределяется по атому. Эксперименты по резерфордскому рассеянию показали, что положительный заряд атома обязательно ограничен небольшой областью атома, которая позже стала известна как атомное ядро.
–Электроны имеют определенное распределение внутри каждого атома. Электроны не распределены равномерно, как изюм в знаменитом пудинге, а вместо этого имеют расположение на орбиталях, которое показали более поздние модели.
Именно расположение электронов внутри атома позволяет упорядочивать элементы по их характеристикам и свойствам в периодической таблице. Это было важным ограничением модели Томсона, которое не могло объяснить, как можно было упорядочить элементы таким образом.
–Атомное ядро - это то, что содержит большую часть массы. Модель Томсона постулировала, что масса атома равномерно распределена внутри него. Но сегодня мы знаем, что масса атома практически сосредоточена в протонах и нейтронах ядра.
Также важно отметить, что эта модель атома не позволяла сделать вывод о типе движения электронов внутри атома
Мюон
Мюоны имеют такой же отрицательный заряд, как и электроны, но в 200 раз больше массы. Они возникают, когда частицы высокой энергии, называемые космическими лучами, врезаются в атомы в атмосфере Земли.
Путешествуя со скоростью, близкой к скорости света, мюоны осыпают Землю со всех сторон. Каждая область планеты размером с руку поражена примерно одним мюоном в секунду, и частицы могут пройти через сотни метров твердого материала, прежде чем они будут поглощены.
По словам Кристины Карлогану, физика из Физической лаборатории Клермон-Феррана во Франции, их вездесущность и проникающая способность делают мюоны идеальными для визуализации больших плотных объектов без их повреждения.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.
Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.
Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
-
/10
Вопрос 1 из 10




























