Углерод
«Углерод встречается в природе как в свободном, так и в соединенном состоянии, в весьма различных формах и видах. В свободном состоянии углерод известен по крайней мере в трех видах : в виде угля, графита и алмаза . В состоянии соединений углерод входит в состав так называемых органических веществ, т. е. множества веществ, находящихся в теле всякого растения и животного. Он находится в виде углекислого газа в воде и воздухе, а в виде солей углекислоты и органических остатков в почве и массе земной коры. Разнообразие веществ, составляющих тело животных и растений, известно каждому. Воск и масло, скипидар и смола, хлопчатая бумага и белок, клеточная ткань растений и мускульная ткань животных, винная кислота и крахмал — все эти и множество иных веществ, входящих в ткани и соки растений и животных, представляют соединения углеродистые. Область соединений углерода так велика, что составляет особую отрасль химии, т. е. химии углеродистых или, лучше, углеводородистых соединений».
органических остатков в почве и массе земной коры. Разнообразие веществ, составляющих тело животных и растений, известно каждому. Воск и масло, скипидар и смола, хлопчатая бумага и белок, клеточная ткань растений и мускульная ткань животных, винная кислота и крахмал — все эти и множество иных веществ, входящих в ткани и соки растений и животных, представляют соединения углеродистые. Область соединений углерода так велика, что составляет особую отрасль химии, т. е. химии углеродистых или, лучше, углеводородистых соединений».
Эти слова из «Основ химии» Д. И
Менделеева служат как бы развернутым эпиграфом к нашему рассказу о жизненно важном элементе — углероде. Впрочем, есть здесь один тезис, с которым, с точки зрения современной науки о веществе, можно и поспорить, но об этом ниже
Вероятно, пальцев на руках хватит, чтобы пересчитать химические элементы, которым не была посвящена хотя бы одна научная книга. Но самостоятельная научно-популярная книга — не какая-нибудь брошюрка на 20 неполных страницах с обложкой из оберточной бумаги, а вполне солидный том объемом почти в 500 страниц — есть в активе только одного элемента — углерода.
И вообще литература по углероду — богатейшая. Это, во-первых, все без исключения книги и статьи химиков- органиков; во-вторых, почти все, что касается полимеров; в-третьих, бесчисленные издания, связанные с горючими ископаемыми; в-четвертых, значительная часть медикобиологической литературы…
Поэтому не будем пытаться объять необъятное (ведь не случайно авторы популярной книги об элементе № 6 назвали ее «Неисчерпаемый»!, а сконцентрируем внимание лишь на главном из главного — попытаемся увидеть углерод с трех точек зрения. Углерод — один из немногочисленных элементов «без роду, без племени»
История общения человека с этим веществом уходит во времена доисторические. Имя первооткрывателя углерода неизвестно, неизвестно и то, какая из форм элементного углерода — алмаз или графит — была открыта раньше. И то и другое случилось слишком давно. Определенно утверждать можно лишь одно: до алмаза и до графита было открыто вещество, которое еще несколько десятилетий назад считали третьей, аморфной формой элементного углерода — уголь. Но в действительности уголь, даже древесный, это не чистый углерод. В нем есть и водород, и кислород, и следы других элементов. Правда, их можно удалить, но и тогда углерод угля не станет самостоятельной модификацией элементного углерода. Это было установлено лишь во второй четверти нашего века. Структурный анализ показал, что аморфный углерод — это по существу тот же графит. А значит, никакой он не аморфный, а кристаллический; только кристаллы его очень мелкие и больше в них дефектов. После этого стали считать, что углерод на Земле существует лишь в двух элементарных формах — в виде графита и алмаза
Углерод — один из немногочисленных элементов «без роду, без племени». История общения человека с этим веществом уходит во времена доисторические. Имя первооткрывателя углерода неизвестно, неизвестно и то, какая из форм элементного углерода — алмаз или графит — была открыта раньше. И то и другое случилось слишком давно. Определенно утверждать можно лишь одно: до алмаза и до графита было открыто вещество, которое еще несколько десятилетий назад считали третьей, аморфной формой элементного углерода — уголь. Но в действительности уголь, даже древесный, это не чистый углерод. В нем есть и водород, и кислород, и следы других элементов. Правда, их можно удалить, но и тогда углерод угля не станет самостоятельной модификацией элементного углерода. Это было установлено лишь во второй четверти нашего века. Структурный анализ показал, что аморфный углерод — это по существу тот же графит. А значит, никакой он не аморфный, а кристаллический; только кристаллы его очень мелкие и больше в них дефектов. После этого стали считать, что углерод на Земле существует лишь в двух элементарных формах — в виде графита и алмаза.
Реакции по алкильному заместителю
Рассмотрим эти реакции на примере гомологов бензола.
Метильная группа в толуоле проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Бензольное кольцо обладает отрицательным индуктивным эффектом по отношению к метальной группе. В результате этого она становится значительно более активной по сравнению с метильной группой в алифатических соединениях.
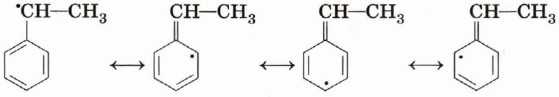
Алкильные производные бензола гораздо охотнее и при более мягких условиях вступают в реакции свободнорадикального замещения (например, хлорирования) на свету, причём замещается водород в основном при атоме, который непосредственно присоединён к бензольному кольцу:
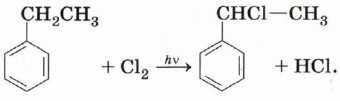
Дело в том, что свободный радикал с неспаренным электроном у этого атома стабилизируется за счёт распределения электрона по атомам ароматической системы (делокализации).
Кроме того, толуол можно окислить водным раствором перманганата калия, подкисленного серной кислотой, с образованием бензойной кислоты. Подобная реакция совершенно нехарактерна для алканов:

Изомерия и номенклатура
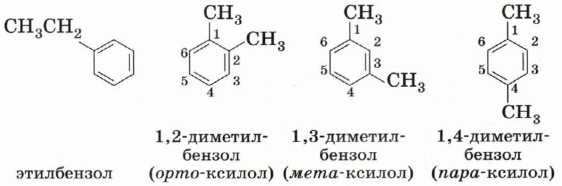
Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метилбензол) не имеет таких изомеров, уже следующий гомолог представлен в виде четырёх изомеров.
Основой названия ароматического углеводорода с небольшими заместителями является слово «бензол».
Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему.
Нумерацию проводят по самому короткому пути: например, вещество
называется 1,3-диметилбензол, а не 1,5-диметилбензол.
Для дизамещённых производных бензола изомеры различаются взаимным положением заместителей в бензольном кольце. В названии изомера с расположением заместителей у соседних атомов углерода используют приставку орто- (от греч. orthos — прямой), через один атом углерода — мета- (от греч. meta — после), для находящихся напротив друг друга — пара- (от греч. рага — против). Таким образом, тривиальные названия приведённых выше диметилбензолов орто-ксилол, мета-ксилол и пара-ксилол.
Сотрудничество продолжается
К сожалению, после начала СВО во взаимодействии с иностранными учеными и компаниями появились некоторые проблемы. Включение ФИАН в санкционные списки в определенной степени является оценкой его заслуг в области квантовых технологий, но такое «признание» привело к дополнительным трудностям. Например, необходимую для установки вакуумную камеру, к которой предъявляются очень высокие требования по чистоте и глубине вакуума, пришлось поискать. Ряд иностранных компаний, имеющих опыт изготовления подобных установок, отказались от сотрудничества, ссылаясь на санкции. На начало года было получено только одно коммерческое предложение от зарубежной компании, но и она впоследствии отказалась от своего предложения.
В России, разумеется, тоже есть производители высоковакуумных установок, но они также сегодня находятся в трудном положении из-за нарушения логистических связей. Несмотря на эти трудности, в настоящее время изготовление основной вакуумной камеры и других не менее сложных частей установки производится компанией «Опытное конструкторское бюро «Оптические системы» (Санкт-Петербург).

Сотрудничество же с руководителем гранта Ральфом Кайзером продолжается. Как отмечает Валерий Азязов, современная наука невозможна без коллабораций, а научные связи, возникающие между исследователями, нацеленными на решение общих задач, трудно разрушить политикой.
«В университете на Маноа под руководством Ральфа Кайзера проводятся эксперименты, результаты которых интерпретируются с помощью сложнейших расчетов, которые проводятся здесь, в Самаре. Уже вышло много совместных публикаций в самых высокорейтинговых журналах и они продолжают появляться даже после начала СВО», — говорит ученый, добавляя, что, впрочем, Самарский филиал ФИАН уже сталкивался с пока единичными отказами некоторых журналов публиковать статьи под предлогом санкций.
Координатор гранта и заместитель руководителя ЦЛА, директор СФ ФИАН доктор физико-математических наук Валерий Азязов:
— Ведущие сотрудники проекта и молодые исследователи, в том числе студенты Самарского университета, аспиранты Самарского университета и ФИАН, получили большой опыт работы со сложным современным оборудованием, уверенно чувствуют себя в астрохимическом моделировании и квантово-механических расчетах. Они привыкли к высокому темпу работы, к требованиям, предъявляемым к качеству исследований, к публикационной активности и другим атрибутам напряженной исследовательской деятельности. Они смотрят в будущее с оптимизмом. Для нас нет сомнений, что проект стоило начинать и необходимо продолжать».
Структурная изомерия
Способы получения бензола и его гомологов
Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля.
Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя.
Для получения бензола и его гомологов можно использовать несколько реакций.
Дегидрирование циклогексана:
Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
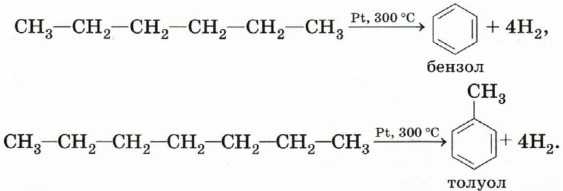
Тримеризация ацетилена:
Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно также несколькими способами.
Синтез Вюрца—Фиттига. Это модификация уже известного нам способа получения алканов:
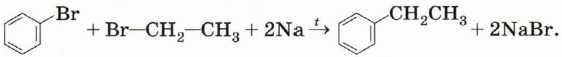
Алкилирование. Взаимодействие бензола и алкена в присутствии кислоты приведёт к образованию ароматического углеводорода:
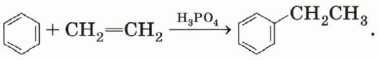
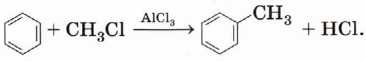
Другой способ — реакция бензола с галогенпроизводным в присутствии хлорида алюминия:
Нуклеиновые кислоты
Нуклеи́новые кислоты
Дезоксирибонуклеиновые и рибонуклеиновые кислоты, универсальные компоненты всех живых организмов, ответственные за хранение, передачу и воспроизведение (реализацию) генетической информации. На два типа все Н. к. делят по углеводному компоненту молекул: дезоксирибозе у дезоксирибонуклеиновых кислот (ДНК) и рибозе у рибонуклеиновых кислот (РНК). Биологическая роль ДНК у большинства организмов заключается в хранении и воспроизведении генетической информации, а РНК — в реализации этой информации в строении молекул белков ( Белки ) в процессе их синтеза.
Нуклеиновые кислоты были обнаружены в 1868 г. швейцарским ученым Мишером (F. Miescher), который установил, что эти вещества локализуются в ядрах клеток, обладают кислотными свойствами и в отличие от белков содержат фосфор. Химически Н. к. являются полинуклеотидами, т.е. биополимерами, построенными из мономерных звеньев — мононуклеотидов, или нуклеотидов (фосфорных эфиров так называемых нуклеозидов — производных пуриновых и пиримидиновых азотистых оснований, D-рибозы или 2-дезокси-D-рибозы). Пуриновыми основаниями, входящими в молекулу ДНК, являются аденин (А) и гуанин (Г), пиримидиновыми — цитозин (Ц) и тимин (Т). В нуклеозидах РНК вместо тимина присутствует урацил (У). В полинуклеотидную цепь нуклеотиды соединяются посредством фосфодиэфирной связи ( рис . 1 ).
Первичная структура Н. к. определяется порядком чередования азотистых оснований, а их пространственная конфигурация — нековалентными взаимодействиями между участками молекулы: водородными связями между азотистыми основаниями, гидрофобными взаимодействиями между плоскостями пар оснований, электростатическими взаимодействиями с участием отрицательно заряженных фосфатных групп и противоионов.
Дезоксирибонуклеиновые кислоты, выделенные из различных организмов, отличаются по соотношению входящих в их состав азотистых оснований, т.е. по нуклеотидному составу, который у всех ДНК подчиняется правилу Чаргаффа: 1) число молекул аденина в молекуле Н. к. равно числу молекул тимина, т.е. А = Т; 2) число молекул гуанина равно числу молекул цитозина, т.е. Г = Ц; 3) число молекул пуриновых оснований равно числу молекул пиримидиновых оснований; 4) число 6-аминогрупп равно числу 6-кетогрупп, что означает, что сумма аденин + цитозин равна сумме гуанин + тимин, т.е. А + Ц = Г + Т. Правило Чаргаффа справедливо и для так называемых минорных азотистых оснований (метилированных или других производных пуриновых и пиримидиновых оснований). Таким образом, нуклеотидный состав каждой ДНК характеризуется постоянной величиной — молярным соотношением
(фактором специфичности) или процентным содержанием Г—Ц-пар, т.е.
. Величина последнего показателя практически одинакова для организмов одного класса. У высших растений и позвоночных животных она составляет 0,55—0,93.
Алканы. Строение и номенклатура
По определению алканы – предельные или насыщенные углеводороды, имеющие линейную или разветвлённую структуру. Также называются парафинами. Молекулы алканов содержат только одинарные ковалентные связи между атомами углерода. Общая формула –
CnH2n+2.
Чтобы назвать вещество, необходимо соблюсти правила. По международной номенклатуре названия формируются с помощью суффикса -ан. Названия первых четырёх алканов сложились исторически. Начиная с пятого представителя, названия составляются из приставки, обозначающей количество атомов углерода, и суффикса -ан. Например, окта (восемь) образует октан.
Для разветвлённых цепей названия складываются:
- из цифр, указывающих номера атомов углерода, около которых стоят радикалы;
- из названия радикалов;
- из названия главной цепи.
Пример: 4-метилпропан – у четвёртого атома углерода в цепи пропана находится радикал (метил).
Рис. 1. Структурные формулы с названиями алканов.
Каждый десятый алкан даёт называние следующим девяти алканам. После декана идут ундекан, додекан и далее, после эйкозана – генэйкозан, докозан, трикозан и т.д.
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Связь биосферы с космосом обеспечивает функция живого вещества. Живое вещество. Функции живого вещества биосферы
Как мы уже обозначали выше, живым веществом рассматриваемой оболочки Земли считается вся совокупность организмов, принадлежащих ко всем царствам природы. Особое же положение среди всех занимают люди. Причинами этого стало:
- потребительская позиция, а не продуцирующая;
- развитие разума и сознания.
Все остальные представители — это живое вещество. Функции живого вещества были разработаны и указаны Вернадским. Он отводил следующую роль организмам:
- Окислительно-восстановительная.
- Деструктивная.
- Транспортная.
- Средообразующая.
- Газовая.
- Энергетическая.
- Информационная.
- Концентрационная.
Самые основные функции живого вещества биосферы — газовая, энергетическая и окислительно-восстановительная. Однако и остальные тоже являются важными, обеспечивающими сложные процессы взаимодействия между всеми частями и элементами живой оболочки планеты.
Рассмотрим каждую из функций более подробно, чтобы понять, что именно подразумевается и в чем суть.
Звезды – вот настоящий источники жизни во Вселенной?
Ученым также удалось показать, что химический состав звездного органического вещества схож с органикой, которую мы находим в метеоритах. А поскольку метеориты – осколки камней, оставшихся зачастую с ранних этапов развития Солнечной системы, то есть основания полагать, что именно звезды обогащают астероиды и другие тела своих формирующихся систем органическим материалом.
«Вполне возможно, что органические соединения в метеоритах были созданы звездами, – считает Квок. – Звездная пыль могла быть выброшена недалекими планетарными туманностями и она пережила космическое путешествие».
На заре земной истории поверхность нашей планеты подверглась мощной бомбардировке метеоритами и кометами, этот период известен как поздняя тяжелая бомбардировка. Поскольку органические материалы в метеоритах похожи на звездные, то можно заключить, что в ходе этой бомбардировки к нам попали органические соединения, созданные звездами.
Пока рано утверждать, что именно эти материалы сыграли важную роль в зарождении жизни на Земле, но это вполне возможно.
«Если это так, то жизни пришлось немного легче, чем при самопроизвольном зарождении. Эти занесенные материалы могли стать базовыми ингредиентами жизни», – говорит Квок.
По мнению Квока, рано складывать оружие. Необходимы дальнейшие исследования, и он сам планирует продолжить изучение инфракрасного излучения, расширяя число осмотренных звезд, чтобы точнее определить химический состав звездной пыли. Кроме этого чрезвычайно интересно понять, как же звезды, раскаленные гиганты в вакууме космоса, оказались способны к созданию сложных органических соединений.
«Уголь – продукт деятельности живых существ, для его образования требует очень много времени, – говорит Квок. – Как звезды создают столь сложные соединения при неблагоприятных условиях и так быстро?»
На этот вопрос астрономам предстоит ответить.
По материалам http://www.nasa.gov/
Звезды создают следы органики в космосе?
Астрономы из Университета Гонконга изучили звезды, находящиеся на разных ступенях эволюции. Оказалось, что на определенных этапах жизни они могут синтезировать сложные органические соединения, которые затем улетают в космос, заполняя межзвездное пространство.
Эти органические вещества столь сложны, что их структура схожа с углем и нефтью, утверждает астроном Сун Квок (Sun Kwok), первый автор публикации исследования в журнале Nature.
Раньше считалось, что столь сложные вещества могут производиться только живыми организмами, но оказывается, что они могут образоваться в космосе, где нет жизни. Их создатели – звезды, причем весь процесс протекает очень быстро.
«Что меня больше всего поразило, это простота, с которой сложные органические соединения создаются звездами, и они находятся повсюду как в нашей галактике, так и в других, – говорит Квок. – Природа умнее, чем мы думали».
Квок и его коллега из университета Йонг Жанг (Yong Zhang) изучили несколько примеров хорошо известного, но загадочного инфракрасного излучения звезд, межзвездного пространства и галактик. Оно известно уже 30 лет, но его источник все еще не определен.
«В астрономическом сообществе принято считать, что за это излучение ответственны полициклические ароматические углеводороды, которые являются простыми ароматическими соединениями углерода и водорода, – говорит Квок. – Наша работа показывает, что эта гипотеза неверна».
Квок и Жанг проанализировали данные Инфракрасной космической обсерватории и телескопа Спитцер, двух телескопов в инфракрасном диапазоне. Ученые изучали звезды, находящиеся на разных этапах своей эволюции. Сначала легкие и средние звезды, затем звезды с протопланетным облаком и, наконец, с планетарным облаком. Последняя стадия характеризуется оболочкой ионизованного газа, распространяющейся от звезды на поздних этапах их жизни.
Оказалось, что загадочное инфракрасное излучение не существует для легких и средних звезд. Но для звезд с протопланетарной туманностью это излучение появляется, причем при переходе в стадию планетарной туманности излучение усиливается.
«Это говорит о том, что органические соединения, ответственные за излучение, создаются в ходе эволюции звезды», – говорит Квок.
Другим удивительным выводом проделанного исследования стала скорость, с которой звезды создают органические соединения и «выплевывают» их в космос.

В космосе уже не раз находили следы органических молекул. Вполне возможно, что оставили их не загадочные инопланетяне, а загадочные… звезды
«Поскольку мы знаем динамический и эволюционный возраст звезд (динамический возраст показывает скорость рассеяния туманности, эволюционный возраст говорит о скорости эволюционирования звезды), мы можем наложить ограничения на характерные времена химических реакций, – говорит Квок. – Поскольку и тот и другой возрасты имеют порядок тысячи лет, анализ спектральных характеристик говорит нам, что органические соединения образуются на временах, меньших тысячи лет».
Ученые также исследовали взрывы звезд и показали, что в ходе этих динамичных космических явлений пыль производится еще быстрее.
«Их спектральные характеристики изменялись от характерных для газа до характерных для пыли за считанные дни или недели, – говорит Квок. – Это говорит о том, что органические соединения, возможно, создаются очень быстро».
Новое исследование, однако, не может быть принято на веру сразу, ведь сейчас принято считать, что звезды не могут создавать сложные органические соединения в вакууме космоса.
«Теоретически, это очень сложно понять из-за очень низкой плотности межзвездного пространства, – поясняет Квок. – Но наши наблюдения достаточно ясны, и нет оснований сомневаться в том, что спектральные характеристики действительно меняются очень быстро. Это значит, что органические соединения образуются в газовой среде».






























