Кто вообще такой Менделеев?
“Трёхногий” портрет отца мировой химии
Удивительно, что именно Менделеев стал родоначальником Периодического закона, ставшего основой периодической системы химических элементов.
Ставший 17-м ребенком директора Тобольской гимназии, он не проявлял призвания к какой-либо науке вплоть до старших курсов гимназии, однажды оставшись на второй год. Со временем ему удалось подтянуться и закончить Главный педагогический институт Петербурга с золотой медалью.
Став учителем в Одессе, он проявлял множество странных, нехарактерных для интеллигента того времени привычек и увлечений. Одним из них было увлечение кожевенным делом и шитьё: Менделеев самостоятельно переплетал книги, делал чемоданы и шил одежду для себя самого.
Пороховые заводы Менделеева
В числе других его увлечений оказалось воздухоплавание, экономика и футурология. Попутно он создал основы современной метрологии, разработал первый ледокол. Занятие естественными науками приводило ученого то к созданию русского бездымного пороха, то к попытке разработки собственной теории эфира для объяснения свойств капиллярных сосудов.
Однако водка, несмотря на устоявшееся мнение, никак не связана с именем Менделеева. Водка родилась задолго до защиты диссертации «О соединении спирта с водой», посвященной на самом деле теории растворов (указал о необходимости учитывать химизм раствора), а не русскому национальному напитку.
Менделеева совершил первый метеорологический полет в России
Но все же главное его открытие — Периодический закон: сегодня его относят к одному из фундаментальных законов мироздания, поскольку она до сих по является аксиоматической, абсолютной.
Это противоречит самим законам науки. Однако, правота Менделеева подтверждается раз за разом. И многое мы видим прямо за экраном своего монитора.
Потенциал для жизни
Измерения Титана показали, что луна скрывает подземный океан жидкой воды (вероятно, смешанный с солями и аммиаком). Зонд Гюйгенс Европейского космического агентства также измерял радиосигналы во время его спуска на поверхность в 2005 году, что указывало на наличие океана на 55 – 80 километров ниже ледяной поверхности. Открытие мирового океана жидкой воды добавляет Титана к горстке миров в нашей Солнечной системе, которые потенциально могут содержать обитаемые среды. Кроме того, реки Титана, озера и моря жидкого метана и этана могут служить обитаемой средой на поверхности спутника, хотя любая жизнь там, вероятно, будет сильно отличаться от жизни на Земле. Хотя до сих пор нет никаких доказательств жизни на Титане, его сложная химия и уникальные среды, несомненно, сделают его местом для продолжения исследований.
Самый радиоактивный металл
Единственным металлом, который может использоваться в качестве топлива в ядерных реакторах, является уран. Многие люди считают его очень опасным из-за высокой радиоактивности. Однако, природный уран безопасен для здоровья человека, а опасность представляет его разновидность под названием U-235 — именно она используется в ядерных реакторах.
Уран-235 использовался при ядерной бомбардировке Хиросимы, в бомбе «Малыш»
Когда-то давно из природного урана даже изготавливали посуду. Например, осколки желтого стекла с содержанием урана были найдены на территории итальянского города Неаполь — по расчетам ученых, стекло было изготовлено в 79 году нашей эры. Он был безопасен для людей и никаких намеков на радиацию вроде свечения не наблюдалось.
Обязательно к прочтению: Что такое Токамак? Просто о термоядерном реакторе
Природного урана U-235, пригодного для использования в ядерных реакторах, сегодня в природе очень мало — на протяжении долгих лет он просто улетучился. Зато, миллиарды лет назад его было очень много, и ядерные реакции могли запускаться прямо на природе,без участия человека. Так, на территории африканской страны Габон, около 1,8 миллиарда лет назад происходила естественная реакция деления ядер урана. Уран горел на протяжении сотен лет, но в итоге реакция прекратилась из-за истощения запасов металла.
Причины изменения цвета титана
1. Оксидация
Одной из основных причин изменения цвета титана является его оксидация. При контакте с воздухом титан может образовывать оксидные пленки на своей поверхности, которые могут придавать ему различные оттенки. В зависимости от условий окружающей среды и времени контакта с воздухом, цвет титана может варьироваться от серебристо-серого до золотисто-желтого.
2. Примеси
Цвет титана также может быть обусловлен присутствием различных примесей. Например, наличие аллюминия может придавать ему сине-зеленый оттенок, а примеси железа — красновато-коричневый или пурпурный цвет. Значительное количество примесей в материале может привести к изменению его цвета в более насыщенные и выраженные тона.
3. Светоотражение
Цвет титана может также зависеть от светоотражающих свойств его поверхности. Различные факторы, такие как структура поверхности, шероховатость, текстура и угол падения света, могут влиять на то, каким образом титан отражает свет. Это может приводить к изменению его цвета и создавать интересные визуальные эффекты.
-
4. Температура
Температурные изменения могут вызывать изменение цвета титана. При нагревании титан может переходить из серебристого состояния в золотисто-желтый или даже голубой оттенок. Это связано с изменением оптических свойств материала и взаимодействием с электромагнитным излучением в видимом спектре.
-
5. Интерференция
Интерференция света — явление, при котором световые волны перекрываются и образуют интерференционную картину. Такое явление может происходить на поверхности титана, если толщина оксидного слоя достигает определенного размера. В результате интерференции света могут наблюдаться яркие и насыщенные цвета, изменяющиеся в зависимости от угла наблюдения.
Изотопы
Известно несколько изотопов титана. Их массовые числа составляют 38-63 (22 протона, 16-41 нейтронов). В состав природного титана входит пять стабильных изотопов: с массовыми числами 46Ti, 47Ti, 48Ti, 49Ti, 50Ti. Существуют искусственные изотопы с продолжительным периодом полураспада: с массовыми числами 44Ti (60 лет), 45Ti (184 минуты).
Титан представляет собой металл серебристо-белого цвета. Плавится он при температуре примерно 1670 °C (в случае нормального давления). При низких температурах (-80 °C) этот элемент становится более хрупким. Он пластичный, вязкий, во время механической обработки налипает на инструменты (предотвратить это можно нанесением специального покрытия). Металл производят из диоксида титана с добавлением небольшого количества примесей, в т.ч. рутилового концентрата, синтетического рутила.
Обладая оксидной пленкой, титан не подвержен коррозии. В виде порошка, стружки, проволоке может самовоспламениться на воздухе. Пыль взрывается, стружка нередко приводит к возникновению пожара. Элемент выдерживает воздействие разбавленных кислотных и щелочных растворов, влажного хлора, водных растворов хлора. За счет комплексообразователей вступает в реакцию со слабыми кислотами. В органической среде может подвергнуться коррозийным процессам из-за попадания воды на металл.
Кюрий
Названный в честь Марии Кюри, кюрий очень радиоактивен. Если выключить свет, кюрий будет светиться фиолетовым. Он вскипятит воду, если вы попытаетесь его погрузить в неё. Он производит альфа -, бета- и гамма-излучение, что делает его реальной угрозой для окружающих. По этой причине его редко производят намеренно, а если и производят, то только в лабораторных условиях.
Вы можете получить кюрий, смешав плутоний и уран в ядерном реакторе. Так что это вряд ли происходит по ошибке. Существует около 20 изотопов кюрия, некоторые из них имеют период полураспада в несколько миллионов лет. Это буквально самый радиоактивный элемент, который известен науке на данный момент.
Месторождения титана в разных странах мира
Австралия
Одним из крупнейших месторождений титана в Австралии является Sill, расположенный в Западной Австралии. Здесь также добывают железную руду и никель. Кроме того, титановые руды добывают в Южной и Северной Австралии.
ЮАР
ЮАР является вторым по величине производителем титана в мире. Крупные месторождения располагаются в Мпумаланга, Квазулу-Натале и Западной Капе. Здесь добываются как сандраститовые, так и ильменитовые руды.
Китай
Китай является крупнейшим производителем титана в мире. Основные месторождения — это платины, расположенные в провинциях Шаньдун и Гуандун. Здесь добываются ильменитовые руды, которые далее перерабатываются в китайские заводы.
Украина
В Украине титановые руды добывают в Кривом Роге. Здесь расположено крупнейшее месторождение титановых и магнетитовых руд в Европе — Центральная группа кварцево-магнетитовых формаций. Добывают также титаномагнетитовые руды Приазовского месторождения в Запорожской области.
Бразилия
Бразилия является крупнейшим производителем титановых руд в Южной Америке. Здесь добывают руды, содержащие ильменит и рутил, в штатах Баия и Минас-Жерайс.
История
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные окислы титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Гореть и никаких гвоздей!
Но нет, не это делает титан уникальным. А то, что его температура плавления составляет около 1600 °C. Что выше температуры горения!
Другими словами, в отличие от, скажем, железа, Вы, к большому сожалению, никогда не сможете использовать обычную кузницу, чтобы расплавить титан. И сделать из него меч. (Если Вы, конечно, не житель другого мира, где атмосфера состоит из какого-нибудь инертного газа). Потому что, когда Вы нагреете титан для того, чтобы его расплавить, задолго до того, как он станет достаточно горячим для этого, он просто сгорит!
На практике титан приходится плавить в специальных вакуумных камерах. Или в атмосфере, состоящей из инертного газа. Что тоже добавляет стоимости продукции из титана.
Однако, несмотря на все трудности, связанные с добычей и применением титана, сегодня он широко используется. Поскольку все его плюсы перевешивают все его минусы.
Ежегодное мировое производство титана составляет более 5-7 миллионов тонн! 95 процентов металла добывается в составе оксида титана TiO2.
Некоторые другие соединения титана, хотя и не такие распространённые, как TiO2, тоже обладают очень интересными свойствами. Например, нитрид титана (TiN) имеет красивый золотистый цвет и исключительную твёрдость. почти такую же твёрдость, как сапфир (9,0 по шкале Мооса). Поэтому его иногда используют для покрытия поверхностей пил, буров и свёрл.
 Сверло с титановым напылением. Фото НАСА.
Сверло с титановым напылением. Фото НАСА.
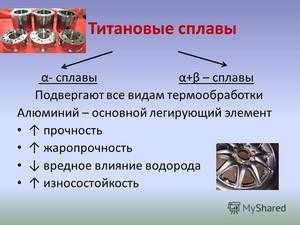
Свойства и применение титановых сплавов
Ниже представлен обзор наиболее часто встречающихся титановых сплавов, которые делятся на классы, их свойства, преимущества и промышленные применения.
7 класс
 Класс 7 механически и физически эквивалентен классу 2 чистого титана, за исключением добавления промежуточного элемента палладия, что делает его сплавом. Он обладает превосходной свариваемостью и эластичностью, наиболее коррозионной стойкостью из всех сплавов этого типа.
Класс 7 механически и физически эквивалентен классу 2 чистого титана, за исключением добавления промежуточного элемента палладия, что делает его сплавом. Он обладает превосходной свариваемостью и эластичностью, наиболее коррозионной стойкостью из всех сплавов этого типа.
Класс 7 используется в химических процессах и компонентах производственного оборудования.
11 класс
Класс 11 очень похож на класс 1, за исключением добавления палладия для повышения коррозионной стойкости, что делает его сплавом.
Другие полезные свойства
включают оптимальную пластичность, прочность, ударную вязкость и отличную свариваемость. Этот сплав можно использовать особенно в тех случаях, когда коррозия вызывает проблемы:
- химическая обработка;
- производство хлоратов;
- опреснение;
- морские применения.
Ti 6Al-4V, класс 5
 Сплав Ti 6Al-4V, или титан 5 класса, наиболее часто используется. На его долю приходится 50% общего потребления титана во всём мире.
Сплав Ti 6Al-4V, или титан 5 класса, наиболее часто используется. На его долю приходится 50% общего потребления титана во всём мире.
Удобство использования заключается в его многочисленных преимуществах. Ti 6Al-4V может подвергаться термообработке для повышения его прочности. Этот сплав обладает высокой прочностью при малой массе.
Это лучший сплав для использования в нескольких отраслях промышленности
, таких как аэрокосмическая, медицинская, морская и химическая перерабатывающая промышленность. Его можно использовать при создании:
- авиационных турбин;
- компонентов двигателя;
- конструктивных элементов самолёта;
- аэрокосмических крепёжных изделий;
- высокопроизводительных автоматических деталей;
- спортивного оборудования.
Ti 6AL-4V ELI, класс 23
 Класс 23 — хирургический титан. Сплав Ti 6AL-4V ELI, или класс 23, является версией более высокой чистоты Ti 6Al-4V. Он может быть изготовлен из рулонов, нитей, проводов или плоских проводов. Это лучший выбор для любой ситуации, когда требуется сочетание высокой прочности, малой массы, хорошей коррозионной стойкости и высокой вязкости. Он обладает превосходной устойчивостью к повреждениям.
Класс 23 — хирургический титан. Сплав Ti 6AL-4V ELI, или класс 23, является версией более высокой чистоты Ti 6Al-4V. Он может быть изготовлен из рулонов, нитей, проводов или плоских проводов. Это лучший выбор для любой ситуации, когда требуется сочетание высокой прочности, малой массы, хорошей коррозионной стойкости и высокой вязкости. Он обладает превосходной устойчивостью к повреждениям.
Он может использоваться в биомедицинских применениях, таких как имплантируемые компоненты из-за его биосовместимости, хорошей усталостной прочности. Его также можно использовать в хирургических процедурах для изготовления таких конструкций:
- ортопедические штифты и винты;
- зажимы для лигатуры;
- хирургические скобы;
- пружины;
- ортодонтические приборы;
- криогенные сосуды;
- устройства фиксации кости.
12 класс
 Титан класса 12 обладает отличной высококачественной свариваемостью. Это высокопрочный сплав, который обеспечивает хорошую прочность при высоких температурах. Титан класса 12 обладает характеристиками, подобными нержавеющим сталям серии 300.
Титан класса 12 обладает отличной высококачественной свариваемостью. Это высокопрочный сплав, который обеспечивает хорошую прочность при высоких температурах. Титан класса 12 обладает характеристиками, подобными нержавеющим сталям серии 300.
Его способность формироваться различными способами делает его полезным во многих приложениях. Высокая коррозионная стойкость этого сплава также делает его неоценимым для производственного оборудования. Класс 12 можно использовать в следующих отраслях:
- теплообменники;
- гидрометаллургические применения;
- химическое производство с повышенной температурой;
- морские и воздушные компоненты.
Ti 5Al-2,5Sn
Ti 5Al-2,5Sn — это сплав, который может обеспечить хорошую свариваемость с устойчивостью. Он также обладает высокой температурной стабильностью и высокой прочностью.
Ti 5Al-2,5Sn в основном используется в авиационной сфере, а также в криогенных установках.
История
Открытие TiO 2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные окислы титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI 4 .
Чтобы найти Титаник понадобилось более 70 лет
Только в 1985 году было найдено судно Титаника. Вскоре после этого стали появляться новые факты о Титанике. Споры вызывал вопрос, погрузился ли Титаник как одно целое. Один из пассажиров «Карпатии» описал сцену, в которой Титаник разламывается пополам перед тем, как погрузиться. Этот факт никак не могли доказать, пока не нашли судно.
 Титаник под водой
Титаник под водой
В сентябре 1985 года команде французских и американских исследователей удалось обнаружить затонувший корабль «Титаник». Титаник сломался надвое, и еще больше фактов о Титанике были подтверждены. Команда показала, что Титаник затонул более чем в 13 милях от координат, предоставленных операторами беспроводной связи на корабле.
Применение[]
Файл:Ti covered watches.jpg
Часы из титанового сплава
В виде сплавов
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы), лёгких сплавах, остеопротезах. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Титан является легирующей добавкой в некоторых марках стали.
- Нитинол (никель-титан) — сплав, обладающего памятью формы и применяемого в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки.
- Диборид титана — важный компонент сверхтвердых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов.
Анализ рынков потреблени
В компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
- 60 % — краска;
- 20 % — пластик;
- 13 % — бумага;
- 7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмноцентрированной упаковкой, температура полиморфного превращения αβ 883 °C.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Другие заметки по химии
Интересные факты о титане
Титан – это химический элемент, открытый в 1791 году в Германии. Он получил свое название в честь древнегреческого бога Титана, который был сыном Геи (Земли) и Урана (Неба).
Титан является легким, прочным и коррозионностойким металлом. Он используется в промышленности для производства самолетов, кораблей, автомобильных деталей и медицинской техники.
Титан – один из самых распространенных элементов в Земной коре. В природе он встречается в виде руды, главным образом – илменита. Крупнейшими добывающими странами являются Австралия, Южная Африка и Канада.
- Титан является инертным элементом и не реагирует с кислородом, водой и щелочами.
- Сильно окрашенные кристаллы илменита могут послужить драгоценным камнем, известным как «блэк-холе-сапфир».
| Символ | Атомный номер | Атомная масса |
|---|---|---|
| Ti | 22 | 47,87 |
Титан является ключевым элементом в составе белков, таких как коллаген, где он придает им прочность и упругость. Этим свойством титан обосновано его использование в стоматологии и ортопедии.
Титан также использовался для создания космических кораблей и ракет. Он был особенно популярен во времена СССР.
Химические свойства[править | править код]
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми с кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2-.
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Титан против стали — в чем разница между титаном и сталью
По сравнению со сталью титан обладает исключительной прочностью и весом, а также отличной биологической совместимостью, что делает его предпочтительным материалом для хирургических имплантатов. Другими распространенными областями применения титана являются аэрокосмическая и ювелирная промышленность, что также связано с его легкими характеристиками, высокой прочностью и коррозионной стойкостью к широкому спектру кислот, щелочей и химикатов. В автомобильной промышленности сталь составляет сильную конкуренцию титану, сталь предпочтительнее, когда требуется прочность твердого материала, кроме того, поскольку железа намного больше, чем титана, с меньшими затратами на сырье, сталь обычно дешевле титана.
Ссылки[править | править код]
- Титан на Webelements
- Титан в Популярной библиотеке химических элементов
- Промышленные типы месторождений титана
- Титан и его сплавы
- Добыча титана и циркония на «Центральном» в Тамбовской области обещает быть одной из самых дешёвых в мире
- Отечественная минерально-сырьевая база титана
- Аэробусы будут делать из русского титана // 2009
Власти Украины вернули в госсобственность два горно-обогатительных комбината (ГОК), которые арендовала компания «Крымский титан», принадлежащая Дмитрию Фирташу // (Иршанский ГОК (Житомирская область) и Вольногорский ГОК (Днепропетровская область)) 2014
На Титане может быть жизнь
Эксперименты показали, что при взаимодействии атмосферы Титана с ультрафиолетовым излучением со стороны Солнца могут появляться такие полимеры, как толины и другие сложные органические молекулы. Фактически, работая с «газовым коктейлем», представляющим собой лабораторную копию атмосферы Титана, ученые фиксировали появление строительных блоков ДНК и РНК, а также некоторых белков и аминокислот.
Стоит отметить, что химические и экологические условия в холодных углеводородных озерах Титана настолько отличаются от земных условий, что даже если там присутствует жизнь, то она радикально отличается от жизни на Земле.
Это интересно
- Это самый твердый металл в мире. Металл плавится при температуре от 3200 градусов и выше. Это свойство способствовало тому, что с титаном долгое время не могли работать. Не было подходящего оборудования.
- Входит в ТОП-10 по распространенности.
- Из него делают искусственные драгоценные камни.
- Общее количество мировых запасов составляет более 700 000 000 тон.
- Водоросль кладофора – источник титана. Элемент присутствует в организме человека, больше всего его в селезенке.
- Титановые украшения не боятся влаги. В них можно купаться даже в море (в океане). Они не испортятся.
- В Москве установлен памятник из титана. Принадлежит монумент космонавту Гагарину.
- Если бы не был открыт титан, человеку не удалось бы полететь в космос. При строительстве космических кораблей используется уникальное свойство метала – большая плотность и твердость в сочетании с легкостью. Именно это позволяет развивать сверхзвуковую скорость.
Физико-химические характеристики
Свойства металла хорошо изучены:
-50%
Большой выбор украшений из натуральных камней и минералов со скидкой -50%
- Легко реагирует с кислотами даже малой концентрации.
- Это тугоплавкий металл: температура плавления – 1670°C. Для вскипания требуется вдвое больше.
- Пластичен, хрупкость обретает на морозе (-80°C).
- На прочность влияет степень очистки, но не температура.
- При комнатной температуре покрывается оксидной пленкой, что делает его устойчивым к коррозии (исключая щелочи).
- При обычном давлении существует два вида титана с разными типами решеток: высоко- и низкотемпературный.
| Свойства атома | |
|---|---|
| Название, символ, номер | Тита́н / Titanium (Ti), 22 |
| Атомная масса (молярная масса) |
47,867(1) а. е. м. (г/моль) |
| Электронная конфигурация | 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Электродный потенциал | −1,63 |
| Степени окисления | 2, 3, 4 |
| Энергия ионизации (первый электрон) |
657,8 (6,8281) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 4,54 г/см³ |
| Температура плавления | 1670 °C 1943 K |
| Температура кипения | 3560 K |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a=2,951 с=4,697 (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 21,9 Вт/(м·К) |
| Номер CAS | 7440-32-6 |
Из-за повышенной вязкости механическая обработка металла затруднена. Этот недостаток устраняют, смазывая инструмент специальными составами.
Получение
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а невосстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
TiO2 + 2C + 2Cl2 =TiCl2 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
TiCl4+ 2Mg = 2MgCl2+ Ti
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.





























