«Пожелать ученым удачи»
По словам Максима Пака,сегодня химиотерапию используют как в монорежиме, так и в различных комбинациях с лучевой и иммунно-таргетной терапией. Вместе с тем, сегодня ученые стремятся создать принципиально новый класс препаратов.
— Если нашим коллегам-ученым удастся создать препарат, который снизит токсичность за счет адресного воздействия на опухолевые клетки, это уменьшит частоту нежелательных явлений и позволит не нарушать цикличность лечения, тем самым повысив его эффективность, — объясняет собеседник «Известий».
Как говорит Пак,пока остается «пожелать ученым удачи» и дождаться результатов проведения доклинических испытаний на клеточных культурах и животных. Это позволит оценить работу препарата при различных формах рака и даст возможность перейти к клиническим исследованиям.
В то же времяо полном отказе от химиотерапии в будущем говорить пока не приходится: есть пациенты, которые не поддаются лечению новыми классами препаратов, но им хорошо подходят старые схемы. К примеру, такая терапия (особенно в сочетании с лучевой) показывает высокую эффективность при раке носоглотки, различных органов головы и шеи.
— Пока мы не поймем, почему так происходит, я не вижу перспективы полного перехода на иммуно-таргетную или генную терапию. Сегодня скорее перспективна правильная комбинация препаратов, индивидуально подобранная для каждого пациента. Сегодня во всем мире существует тренд «персонализированная медицина», и мы постепенно идем к этому, — отмечает собеседник «Известий».
Новое лекарство
Инновационный препарат от ракасоздаютсотрудники НИУ МИЭТ вместе с польскими коллегами. По словам ученых,сегодня для лечения рака применяются препараты на основе цисплатина, которые могут замедлять и прекращать рост раковых клеток, но заодно уничтожают здоровые, что негативно сказывается на общем состоянии организма пациента.
Команда ученых синтезировала соединение с высокой противоопухолевой активностью, на основе которого можно будет создать новый препарат против рака. Лекарство будет токсично лишь для раковых клеток и сможет легко удаляться из организма без негативных последствий.
— В основе разработки лежат молекулы органического лиганда, активной частью которых выступают комплексы цинка, меди и кадмия. Мы усилили их свойства за счет физического осаждения наночастиц серебра. Анализ показал, что наибольшую противоопухолевую активность проявляют комплексы с кадмием, — рассказал доцент Института перспективных материалов и технологий НИУ МИЭТ Сергей Дубков.
Наночастицы серебра помогают средству проникать через мембрану раковой клетки и накапливаться в ее внутренних частях, разрушая изнутри. Эти частицы приводят к усилению действия комплекса против почти всех элементов клетки, включая митохондрии, ядро и эндоплазматическую сеть, пояснил Дубков.
Предполагается, что новый препарат будет обнаруживать раковые клетки с помощью технологий «умной» доставки, использующей так называемые адресные молекулы.Сейчас научный коллектив работает над дальнейшим усилением противоопухолевых свойств нового соединения. Сама разработка препарата ведется в рамках госпрограммы Минобрнауки «Приоритет-2030».
Слайд 23 нечувствительность к апоптогенному действию Fas-L (потеря экспрессии или

мутации рецептора смерти Fas, гиперэкспрессия рецептора-ловушки DcR3); нарушения проведения
сигнала к митохондриям (инактивация опухолевых супрессоров р53, PTEN и др.);
подавление выброса из митохондрий цитохрома С(увеличение экспрессии онкогенов семейства Bcl2 и др.); подавление активации каспаз(инактивация APAF-1, мутации Ras, PI3K, PTEN, р53 и др.); уменьшение времени жизни каспаз (связывание каспаз с белками IAP (Inhibitors of Apoptosis), экспрессия которых повышается вследствие активации протоонкогенов Ras, Akt/PKB или инактивации опухолевых супрессоров р53, PTEN и др.)
Механизмы ослабления индукции апоптоза в опухолевых клетках:
Кому подходит
«Универсальность лечения, а именно воздействие на иммунную систему, которая более или менее однообразна у всех больных при разных злокачественных опухолях, позволяет распространить иммунотерапевтические подходы достаточно широко для большинства онкологических пациентов и в большинстве онкологических ситуаций. Это кардинально отличает ее от таргетной терапии, в результате которой пользу получает очень узкая группа больных с конкретной мутацией», — говорит Ирина Балдуева.
Специалистам удалось остановить развитие и взять под контроль такие грозные заболевания, как меланома кожи, саркома мягких тканей, хондросаркома, рак почки. Как правило, это пациенты с исчерпанными возможностями, которые уже не отвечали на стандартные методы лечения, и только вакцинотерапия помогла добиться желаемого эффекта и сохранить им жизнь.
Вот некоторые примеры, которые мы приводим с письменного согласия пациентов.
Инженеру-механику 1963 года рождения из Санкт-Петербурга был поставлен диагноз «хондросаркома правой голени, метастазы в легких и ребрах», проведено четыре оперативных вмешательства, в том числе ампутация правой нижней конечности на уровне нижней трети бедра, а также изолированная метастазэктомия и химиоперфузия легкого. Несмотря на активное стандартное лечение, заболевание прогрессировало и по распространенности достигло четвертой стадии. В результате вакцинотерапии дендритно-клеточными вакцинами произошла стабилизация: прогрессирование заболевания было остановлено, оно больше не угрожает жизни пациента.
«В настоящее время лаборатория онкоиммунологии испытывает дефицит бюджетного и грантового финансирования. Поэтому несмотря на то, что в портфеле научной лаборатории онкоиммунологии около пятнадцати разработок, пять из которых можно использовать для применения в клинике, используются только две. Остальные десять пока заморожены»
Домохозяйка, флорист и создатель хенд-мейд-предметов интерьера 1968 года рождения из Ленинградской области с диагнозом «меланома кожи спины, метастазы в мягкие ткани шеи» пережила три операции, в том числе по удалению надключичных лимфоузлов, и, несмотря на хирургические вмешательства, заболевание прогрессировало до третьей стадии. В результате двенадцати введений дендритной вакцины в сочетании с циклофосфамидом развитие заболевания остановлено, состояние стабилизировано.
Капитан 2-го ранга в отставке, художник из деревни Дубово (Псковская область) 1947 года рождения с диагнозом «саркома мягких тканей локтевого сустава (левая рука), метастазы в мягких тканях левого плеча и предплечья, третья стадия заболевания», прошел через семь операций, курсы лучевой и химиотерапии, но заболевание постоянно рецидивировало. В результате вакцинотерапии в сочетании с фотодинамической терапией и метрономной терапией развитие заболевания удалось остановить.
Девушка 2000 года рождения из Махачкалы (Дагестан) с диагнозом «синовиальная саркома мягких тканей левого бедра» прошла через три хирургических вмешательства, четыре курса полихимиотерапии. Активное стандартное лечение результатов не принесло, химиотерапия оказалась неэффективной, заболевание активно прогрессировало до третьей стадии. В результате пяти введений дендритно-клеточной вакцины удалось достичь полного регресса заболевания.
К сожалению, возможности лаборатории позволяют принять не более 70 пациентов в месяц. Всего пролечено уже более 600 больных.

Клеточные культуры изучаемые в лаборатории
Наталия Михальченко
Инновации для здравоохранения
Компания — резидент «Мосмедпарка» была образована в 2017 году. Уже в конце 2020 года она вывела на российский рынок шесть научно-практических разработок, включая тест-системы для ранней диагностики новой коронавирусной инфекции. На сегодняшний день в активе предприятия девять передовых проектов.
На территории «Мосмедпарка» располагается научная лаборатория компании площадью более тысячи квадратных метров. Производственная площадка находится в Калужской области. Также компания является участником Международного медицинского кластера в «Сколкове».
«Мосмедпарк» — специализированный комплекс на юго-востоке Москвы, который находится под управлением технопарка «Строгино».
Помимо создания и выпуска медицинских изделий, оборудования и лекарственных препаратов, резиденты «Мосмедпарка» специализируются на приборостроении и информационных технологиях.
Взаимодействие некроптоза, аутофагии и апоптоза при митотической катастрофедоклад на конференции
-
Авторы:
Александра Юрьевна Егоршина,
Алексей Владимирович Замараев,
Борис Давидович Животовский,
Гелина Сергеевна Копеина
-
Всероссийская с международным участием Конференция (Конгресс) :
IV Национальный конгресс по регенеративной медицине -
Даты проведения конференции:
20-23 ноября 2019 -
Дата доклада:
21 ноября 2019 -
Тип доклада:
Устный
-
Докладчик:
Александра Юрьевна Егоршина
-
Место проведения:
Москва, Russia -
Аннотация доклада:
Митотическая катастрофа — это состояние клетки, которое вызывается нарушениями в митозе, такими как грубые хромосомные аберрации или дефекты митотического веретена деления. Митотическая катастрофа представляет собой один из механизмов подавления формирования и роста опухолей, а также успешно используется в клинической практике, как стратегия лечения онкологических заболеваний. События, следующие за митотической катастрофой, напрямую зависят от баланса между белками, регулирующими пути гибели клеток. Таким образом, митотическая катастрофа может привести к апоптотической, некротической и аутофагической гибели клеток. В настоящее время механизм некротической гибели клеток, вызываемой митотической катастрофой, остается неизвестным.
В данной работе митотическая катастрофа была индуцирована в клеточных линиях карциномы яичника (Caov-4) и колоректального рака (HCT116 wt и HCT116 p53-/-) с использованием химиотерапевтических препаратов в низких концентрациях, таких как доксорубицин (600 нМ), повреждающий ДНК, и колцемид (10 мкг/мл), деполимеризующий микротрубочки. Вестерн-блот анализ продемонстрировал увеличение фосфорилирования некроптотических эффекторов MLKL и RIP-1 после обработки клеток доксорубицином или колцемидом в течение 48 часов. В этих условиях в клеточных линиях Caov-4 и HCT116 детектировалось формирование комплекса RIPoptosome, обеспечивающего активацию RIP-1. Необходимо отметить, что клетки HCT116 р53-/- были более склонны к фосфорилированию RIP-1 и, соответственно, последующему некроптозу. Ингибирование некроптоза с использованием некростатина-1s повышало уровень апоптотической гибели клеток в HCT116 wt, а блокировка некроптоза в отсутствие р53 (HCT116 p53-/-) приводила к повышению уровня аутофагии. Однако, ингибирование аутофагии с использованием бафиломицина А1 не стимулировало RIP-1-зависимый некроптоз, а усиливало апоптоз.
Согласно полученным данным, митотическая катастрофа, помимо апоптоза и аутофагии, приводит к RIP1-зависимому некроптозу при обработке колцемидом или доксорубицином клеток Caov-4 и HCT116. При этом взаимосвязь между апоптозом, RIP-1-зависимым некроптозом и аутофагией регулируется р53.
Исследование проведено при поддержке Российского фонда фундаментальных исследований (грант
№18-015-00211). -
Добавил в систему:
Егоршина Александра Юрьевна
Уничтожение клеток
Как говорит «Известиям» врач-онколог клинического госпиталя «Лапино» Максим Пак,все современные препараты против рака, которые разрабатываются в мире, направлены на высокую эффективность лечения и одновременно низкую токсичность.
— Химиотерапия, которая сейчас широко применяется, обладает высокой степенью токсичности и частотой нежелательных явлений. Помимо того, что химиопрепараты убивают опухоль, они уничтожают и нормальные клетки крови, понижая уровень тромбоцитов, лейкоцитов и эритроцитов,— рассказывает врач.
Обратная сторона химиотерапии чревата и развитием анемии, присоединением вторичной инфекции и развитием недостаточности различных органов и систем: сердечной, почечной, печеночной и других. В результате пациенты не всегда успевают восстановиться между курсами лечения.
— Длительное проведение химиотерапии может быть затруднительно, а в ряде случаев невозможно: мы не можем завершить десять, шесть или даже четыре курса, так как состояние пациента не позволяет продолжить лечение. Потому мы вынуждены приостанавливать терапию, делать перерывы в лечении, тем самым нарушая цикличность, редуцировать дозы препаратов, менять схемы лечения. Всё это сказывается на эффективности лечения, — говорит онколог.
Опасность рака легкого
По данным Всемирной организации здравоохранения (ВОЗ), сегоднярак легкого — самый распространенный вид рака у мужчин (у женщин — рак молочной железы). В 2020 году в мире было выявлено 2,21 млн случаев заболевания, умерли 1,8 млн пациентов с таким диагнозом (в России — около 27 тыс.). В России ежегодно регистрируется более 62 тыс. новых случаев заболевания, при этом на ранние стадии приходится лишь 30%.
— Рак легкого — это собирательный термин для обозначения множества различных злокачественных опухолей органа, — рассказывает «Известиям» торакальный хирург, онколог ФНКЦ ФМБА России Евгений Епифанцев. — У него есть несколько факторов риска: курение, профессиональная вредность (контакт с асбестом, тяжелыми металлами, работа в горнодобывающей и химической промышленности), в некоторых случаях сказывается генетическая предрасположенность.
Выявить рак легкого на ранней стадии сложно из-за того, что пациенты редко обращают внимание на первые симптомы: усталость, снижение аппетита, кашель и похудение. Их легко спутать с переутомлением или списать на стрессовые ситуации
Специфические симптомы болезни появляются уже на поздних стадиях — к ним относятся кашель с прожилками крови, одышка, боль в груди, охриплость голоса и частые воспалительные заболевания легких.
По словам врача,при наличии факторов риска и любых из этих симптомов (включая ранние) пациенту показано проведение КТ. Этот метод позволит получить достоверную информацию о локализации опухоли и других изменениях в органах грудной клетки.
— Наличие любого новообразования требует консультации торакального хирурга, онколога. Способ лечения назначается в зависимости от типа рака легкого, — рассказывает собеседник «Известий».
Шанс на выздоровление, как правило, зависит от стадии заболевания: на первой он превышает 60%, а на второй — 50%. Дальше вероятность снижается.
Опухолевые клетки будут уничтожать по-новому
4 декабря 2017 года
Группа исследователей с биологического факультета МГУ имени М.В. Ломоносова предложила новый подход к уничтожению опухолевых клеток. Ученые во главе с Борисом Животовским, руководителем Лаборатории исследования механизмов апоптоза, изучили особенности митотической катастрофы – процесса, нарушающего нормальное деление клетки.
Явление митотической катастрофы было обнаружено в середине прошлого века при изучении реакции клеток на облучение. Клетка при этом сильно увеличивается в размерах, в ней появляются многочисленные ядра.
«Если на нормальную клетку подействовать небольшими дозами радиации, она может превратиться в клетку в состоянии митотической катастрофы, – поясняет Борис Животовский. – Клетка может увеличить свой объем, а затем начать делиться. И, соответственно, это приводит к развитию опухолей».
Авторы изучили, какие компоненты клетки принимают участие в регуляции процесса запуска митотической катастрофы, обратив особое внимание на митохондрии – клеточные органеллы, участвующие в энергообмене клетки, а также в запуске процесса апоптоза – клеточной гибели. Исследователи индуцировали митотическую катастрофу в опухолевых клетках, воздействуя на них доксорубицином и колцемидом
Эти препараты влияли на клеточный цикл и препятствовали нормальному делению клетки. Оказалось, что колцемид препятствовал доступу кислорода к митохондриям, что и вызывало гибель клеток. Кроме того, митотическая катастрофа оказалась способна запускать аутофагию, естественный процесс, также приводящий к гибели клеток. Это происходило при увеличении в клетке концентраций белков Mcl-1 и Bcl-xL
Исследователи индуцировали митотическую катастрофу в опухолевых клетках, воздействуя на них доксорубицином и колцемидом. Эти препараты влияли на клеточный цикл и препятствовали нормальному делению клетки. Оказалось, что колцемид препятствовал доступу кислорода к митохондриям, что и вызывало гибель клеток. Кроме того, митотическая катастрофа оказалась способна запускать аутофагию, естественный процесс, также приводящий к гибели клеток. Это происходило при увеличении в клетке концентраций белков Mcl-1 и Bcl-xL.
Сейчас исследователи проверяют, какие именно вещества и в каких концентрациях, могут вызывать избирательную гибель опухолевых клеток, не влияя при этом на здоровые. Не исключено, что в дальнейшем это приведет к появлению нового класса противоопухолевых препаратов, которые окажутся более эффективными и более безопасными, чем существующие сейчас лекарства и методы.
Опубликовано в категории: Новости Метки: исследование, лечение, опухолевые клетки, уничтожение
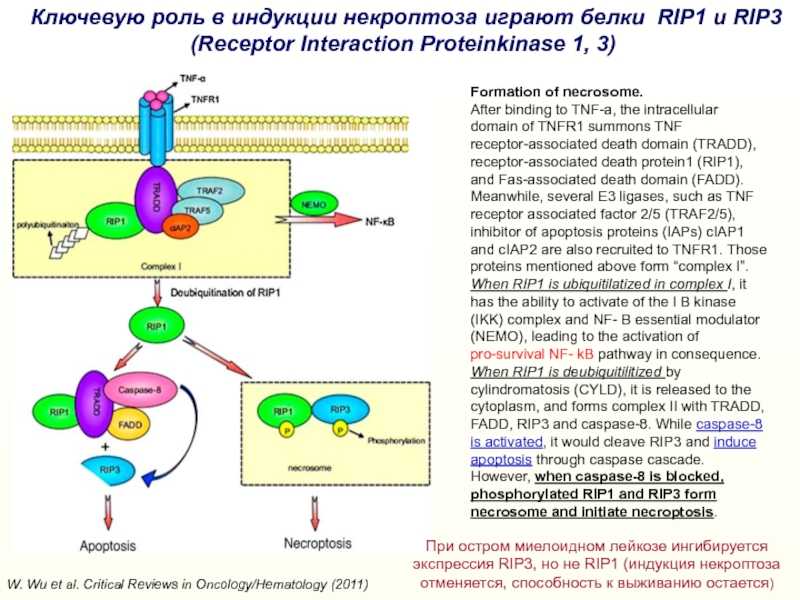
Слайд 33W. Wu et al. Critical Reviews in Oncology/Hematology (2011) Ключевую
роль в индукции некроптоза играют белки RIP1 и RIP3 (Receptor
Interaction Proteinkinase 1, 3)
Formation of necrosome.After binding to TNF-a, the intracellular domain of TNFR1 summons TNF receptor-associated death domain (TRADD), receptor-associated death protein1 (RIP1), and Fas-associated death domain (FADD). Meanwhile, several E3 ligases, such as TNF receptor associated factor 2/5 (TRAF2/5), inhibitor of apoptosis proteins (IAPs) cIAP1 and cIAP2 are also recruited to TNFR1. Those proteins mentioned above form “complex I”. When RIP1 is ubiquitilatized in complex I, it has the ability to activate of the I B kinase (IKK) complex and NF- B essential modulator (NEMO), leading to the activation of pro-survival NF- kB pathway in consequence. When RIP1 is deubiquitilitized by cylindromatosis (CYLD), it is released to the cytoplasm, and forms complex II with TRADD, FADD, RIP3 and caspase-8. While caspase-8 is activated, it would cleave RIP3 and induce apoptosis through caspase cascade. However, when caspase-8 is blocked, phosphorylated RIP1 and RIP3 form necrosome and initiate necroptosis.
При остром миелоидном лейкозе ингибируется экспрессия RIP3, но не RIP1 (индукция некроптоза отменяется, способность к выживанию остается)
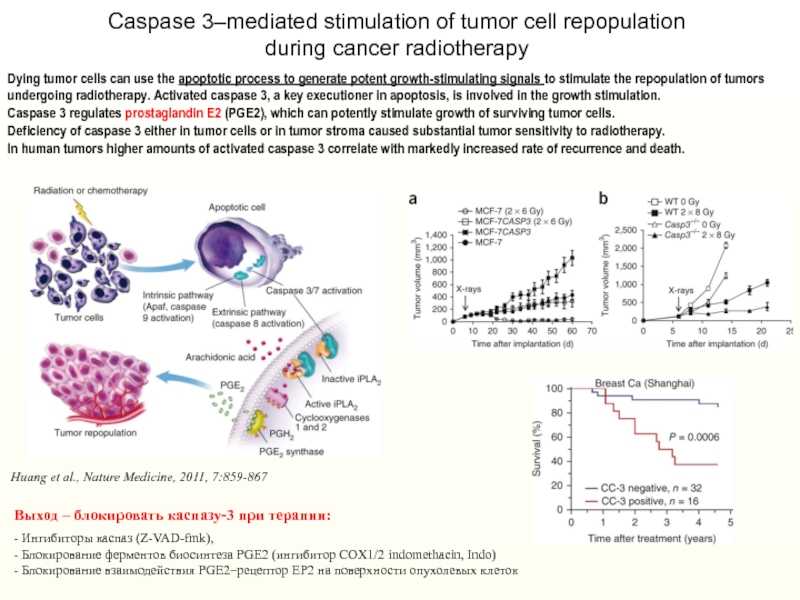
Слайд 26Dying tumor cells can use the apoptotic process to generate
potent growth-stimulating signals to stimulate the repopulation of tumors undergoing
radiotherapy. Activated caspase 3, a key executioner in apoptosis, is involved in the growth stimulation. Caspase 3 regulates prostaglandin E2 (PGE2), which can potently stimulate growth of surviving tumor cells. Deficiency of caspase 3 either in tumor cells or in tumor stroma caused substantial tumor sensitivity to radiotherapy. In human tumors higher amounts of activated caspase 3 correlate with markedly increased rate of recurrence and death.
Huang et al., Nature Medicine, 2011, 7:859-867
Caspase 3–mediated stimulation of tumor cell repopulation during cancer radiotherapy
Выход – блокировать каспазу-3 при терапии:- Ингибиторы каспаз (Z-VAD-fmk), — Блокирование ферментов биосинтеза PGE2 (ингибитор COX1/2 indomethacin, Indo) — Блокирование взаимодействия PGE2–рецептор EP2 на поверхности опухолевых клеток
Новости
читать все
-
ОРВИ больше не будут лечить антибиотиками
Новый стандарт лечения респираторно-вирусных инфекций, предложенный Минздравом, выводит использование антибиотиков из перечня рекомендуемых препаратов, одновременно расширяется список утверждаемых противовирусных лекарств. Проект приказа опубликован на портале правовых документов. В основу новых стандартов положены клинические рекомендации «Острые респираторные вирусные инфекции (ОРВИ) у взрослых», разработанные Российским научным медицинским обществом терапевтов и Национальным научным обществом инфекционистов. Предыдущий документ был принят десять
ЧитатьРегуляторика
11.10.2023
37
События -
Денис Мантуров: «Сегодня мы ставим перед собой задачу и цель обеспечить себя собственными компонентами, собственными субстанциями из своего сырья»
В Сочи завершился форум БИОТЕХМЕД-2023. Мероприятие посетило около 1000 участников из 6 регионов России, на сессиях выступили более 100 спикеров. Представители профильных министерств и эксперты отрасли обсудили готовность российской промышленности к обеспечению потребностей системы здравоохранения. В мероприятии приняли участие заместитель Председателя Правительства Российской Федерации — Министр промышленности и торговли Российской Федерации Денис Мантуров, Министр здравоохранения
ЧитатьНовости отрасли
11.10.2023
63
События -
На «Лактисе» совместно с учёными разработали продукт из козьего молока для лекарств и БАДов
Крупнейшее в Новгородской области предприятие по выпуску молочной продукции «Лактис» заключило соглашение с Институтом биологии гена РАН о производстве нового продукта по инновационной технологии, сообщает gpvn.ru. Совместная работа ученых и практиков привела к созданию альтернативного источника белка — лактоферина, который получают из молока коз, по свойствам он идентичен человеческому. Лактоферин — это полифункциональный белок естественного
ЧитатьПродукция
10.10.2023
216
События -
Минпромторг и Минздрав решают, кто получит субсидии на разработку лекарств
Минздрав предложил распространить финансовую поддержку разработки лекарств и на препараты, незарегистрированные в России, учитывая планы Минпромторга о субсидировании разработок аналогов лекарств, у которых не истекла патентная защита, сообщает «ФВ». Такое предложение озвучил Сергей Глаголев, заместитель министра здравоохранения на форуме «Биотехмед» в Сочи. Он считает, что запатентованные препараты, не зарегистрированные в России, также могут войти в
ЧитатьРегуляторика
10.10.2023
222
События
Адресное воздействие
По словам Максима Пака, иммунно-таргетные препараты, к которым сегодня всё чаще прибегают в России, были открыты около 20 лет назад, и стали широко применяться в практике в последние 10 лет.Преимущество новых препаратов в том, что они практически не действуют на обычные клетки организма.
— Иммунотерапия помогает собственному протипоопухолевому иммунитету видеть и убивать опухолевые клетки, тогда как таргетная терапия действует на определенную цель, блокирует определенный путь, по которому развивается опухоль, — так развивается противоопухолевый эффект, — объясняет онколог.
Новые лекарства, применяющиеся при лечении рака, обязательно должны быть лучше, чем предыдущие, или хотя бы не хуже, но лучше переноситься пациентом. Проще говоря, у них должны быть преимущества перед «стандартом». — Есть несколько важных задач: прежде всего, увеличение общей или безрецидивной выживаемости пациента и длительности противоопухолевого ответа — иными словами, чтобы пациент как можно дольше находился на терапии, которая была для него эффективна и при этом не страдало качество жизни. Бывает лечение, которое может быть очень эффективным, при этом качество жизни пациента может быть резко снижено: сильная общая слабость, повышение температуры и так далее. Открытие новых препаратов и направлено на решение этих проблем, — заключает собеседник «Известий».
Фото pixels
Лечение без вреда для здоровых клеток
Термин «таргетная терапия» в медицине используют для обозначения точечного лечения злокачественных образований. Этот метод считается более действенным и щадящим для организма, чем, например, химиотерапия, когда при уничтожении раковых клеток могут пострадать и здоровые.
Ученые из специализированного комплекса «Мосмедпарк» разработали способ получения молекул, которые могут выявлять и прицельно уничтожать патологические белки, участвующие в развитии рака и атеросклероза. Молекулы уже подтвердили свою эффективность в экспериментах на клетках, сейчас специалисты начали их тестировать на животных.

С помощью этой технологии компания получила две молекулы. И если одна транспортирует белок в лизосомы, из-за чего достигается эффект замедления роста опухолевых клеток, вторая очищает плазму крови от белка, ответственного за развитие атеросклероза. Такая молекула направляет патологический белок в клетки печени, где он уничтожается в лизосомах по тому же принципу.
Создание молекул для деградации белков — новейшее направление фармакологии. Исследованиями в этой области активно занимаются ученые многих стран, включая представителей крупнейших швейцарских фармацевтических компаний. У российских специалистов из «Мосмедпарка» на создание разработки ушло четыре года. По их словам, новая технология призвана кардинально изменить подход к терапии онкологических и ряда других серьезных заболеваний: с ее помощью можно будет создавать лекарственные молекулы для прицельного уничтожения практически любого мембранного или внеклеточного белка.

































